Lysfarven, der udsendes af et atom, er mest relateret til?
* Elektronenerginiveau: Elektroner i et atom findes i specifikke energiniveauer. Disse niveauer er kvantiseret, hvilket betyder, at de kun kan have specifikke, diskrete mængder energi.
* excitation: Når et atom absorberer energi (fra varme, lys eller andre kilder), kan en elektron hoppe til et højere energiniveau. Dette kaldes excitation.
* de-excitation: Den ophidsede elektron er ustabil og ønsker at vende tilbage til sin jordtilstand (laveste energiniveau). For at gøre det frigiver det den overskydende energi som en foton af lys.
* fotonenergi og farve: Energiforskellen mellem den ophidsede tilstand og jordtilstanden bestemmer energien fra den udsendte foton. Da energien fra en foton er direkte relateret til dens farve (højere energi =kortere bølgelængde =blåere farve), dikterer energiforskellen mellem elektroniveauer farven på det udsendte lys.
Kortfattet: De specifikke energiniveauer inden for et atom dikterer de energiforskelle, som elektroner kan gennemgå, og disse energiforskelle bestemmer farven på lyset, der udsendes, når en ophidset elektron vender tilbage til sin jordtilstand.
Sidste artikelEr produktion af lys ved en lampe fysisk kemikalieændring?
Næste artikelEr fluor en leder af varme?
 Varme artikler
Varme artikler
-
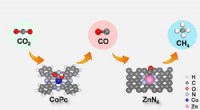 Tandemkatalysator til forbedring af kuldioxidelektroreduktion til metanCO2 reduceres først elektrokemisk til CO og derefter diffunderer CO til Zn-N-C for yderligere omdannelse til CH 4 over CoPc@Zn-N-C tandemkatalysator. Kredit:LIN Long og LIU Tianfu Kuldioxidreduk
Tandemkatalysator til forbedring af kuldioxidelektroreduktion til metanCO2 reduceres først elektrokemisk til CO og derefter diffunderer CO til Zn-N-C for yderligere omdannelse til CH 4 over CoPc@Zn-N-C tandemkatalysator. Kredit:LIN Long og LIU Tianfu Kuldioxidreduk -
 Optisk påvisning af flere bakteriearter ved hjælp af metal-organiske hybrider i nanometerskalaGrafisk abstrakt. Kredit:Analytisk kemi (2022). DOI:10.1021/acs.analchem.2c01188 Forskere fra Osaka Metropolitan University har udviklet en enkel, hurtig metode til samtidigt at identificere flere
Optisk påvisning af flere bakteriearter ved hjælp af metal-organiske hybrider i nanometerskalaGrafisk abstrakt. Kredit:Analytisk kemi (2022). DOI:10.1021/acs.analchem.2c01188 Forskere fra Osaka Metropolitan University har udviklet en enkel, hurtig metode til samtidigt at identificere flere -
 Kemikalieproducenter er imod nye tarifferKredit:CC0 Public Domain I juni, kemiske producenter konvergerede om Washington, D.C., at opfordre US Trade Representative Office (USTR) til at fjerne visse kemikalier fra en ny liste over toldsat
Kemikalieproducenter er imod nye tarifferKredit:CC0 Public Domain I juni, kemiske producenter konvergerede om Washington, D.C., at opfordre US Trade Representative Office (USTR) til at fjerne visse kemikalier fra en ny liste over toldsat -
 En opskalering af nanoporøs membrancentrifuge til afsaltning af omvendt osmose uden tilsmudsningFigur 1. Design og bevis på konceptet for nano-porøs membrancentrifuge:(a), (b), og (c) detaljer i nanoskala af vandmolekyler og Na+/Cl-ioner i nærheden af grafenmembranen; (d) illustration rotation
En opskalering af nanoporøs membrancentrifuge til afsaltning af omvendt osmose uden tilsmudsningFigur 1. Design og bevis på konceptet for nano-porøs membrancentrifuge:(a), (b), og (c) detaljer i nanoskala af vandmolekyler og Na+/Cl-ioner i nærheden af grafenmembranen; (d) illustration rotation
- Hvad betyder 7 grader Celsius i Fahrenheit?
- Farvestofabsorptionsstruktur af farvesensibiliserede solceller belyst på molekylært niveau
- 1/3 af forældrene i 3 stater må ikke sende børn i skole på grund af COVID-19
- Hvordan fungerer en magneto?
- Hvorfor forekommer Earths Sky blå og Mars rød?
- Hæmmet af scientisme? Forsker undersøger historien om amerikansk samfundsvidenskab


