Hvorfor udviser elementerne, der tilhører en bestemt gruppe, lignende kemisk opførsel?
* Valenselektroner: Elementer inden for en gruppe har det samme antal valenselektroner, som er elektronerne i den yderste skal af et atom. Disse valenselektroner er dem, der er involveret i kemisk binding.
* Lignende bindingsmønstre: Da de har det samme antal valenselektroner, har elementer i en gruppe en tendens til at danne lignende typer bindinger og har lignende reaktivitet. For eksempel har alle elementer i gruppe 1 (alkalimetaller) en valenselektron, hvilket fører dem til let at miste denne elektron- og form +1 -ioner.
* Oxidation siger: Elementer i en gruppe udviser ofte lignende oxidationstilstande på grund af deres lignende valenselektronkonfigurationer. Dette betyder, at de har en tendens til at miste eller få elektroner på en lignende måde under kemiske reaktioner.
* Kemiske egenskaber: De lignende bindingsmønstre og oxidationstilstande påvirker direkte et elements kemiske egenskaber. For eksempel er elementer i gruppe 17 (halogener) alle stærkt reaktive ikke -metaller, fordi de let får et elektron for at afslutte deres ydre skal.
Eksempel:
* gruppe 1 (alkalimetaller): Li, Na, K, RB, CS, FR
* Valenselektroner: 1
* Kemisk opførsel: De er alle meget reaktive metaller, der let mister deres ene valenselektron til dannelse af +1 ioner. De reagerer kraftigt med vand, danner hydroxider og brintgas.
Kortfattet: Den lignende kemiske opførsel af elementer i en gruppe stammer fra deres fælles antal valenselektroner, som direkte påvirker deres bindingsmønstre, oxidationstilstande og samlede kemiske egenskaber.
 Varme artikler
Varme artikler
-
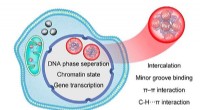 Molekylær mekanisme for ruthenium-kompleks-induceret DNA-faseseparation afsløretMekanismerne til DNA -faseseparation induceret af rutheniumkompleks. Kredit:ZHANG Yuebin og LI Guohui Fænomenet væske-væske faseseparation (LLPS) af biologiske makromolekyler i levende celler regu
Molekylær mekanisme for ruthenium-kompleks-induceret DNA-faseseparation afsløretMekanismerne til DNA -faseseparation induceret af rutheniumkompleks. Kredit:ZHANG Yuebin og LI Guohui Fænomenet væske-væske faseseparation (LLPS) af biologiske makromolekyler i levende celler regu -
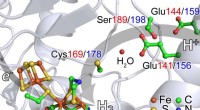 Ny røntgenspektroskopi udforsker brint-genererende katalysatorVed at bruge en nyudviklet teknik og en af verdens mest avancerede røntgenkilder, forskere fra Japan, Tyskland og USA studerer enzymer, der kan producere brintgas. At forstå disse reaktioner kan vær
Ny røntgenspektroskopi udforsker brint-genererende katalysatorVed at bruge en nyudviklet teknik og en af verdens mest avancerede røntgenkilder, forskere fra Japan, Tyskland og USA studerer enzymer, der kan producere brintgas. At forstå disse reaktioner kan vær -
 Sætter spørgsmålstegn ved konventionel forståelse af frostvæskeproteinerEn enkelt iskrystal blev visualiseret samtidigt ved lysfeltmikroskopi (venstre) og Mach-Zehnder-interferometri (højre) for at observere dens henholdsvis morfologi og væksthastigheder. Kredit:Bayer-Gir
Sætter spørgsmålstegn ved konventionel forståelse af frostvæskeproteinerEn enkelt iskrystal blev visualiseret samtidigt ved lysfeltmikroskopi (venstre) og Mach-Zehnder-interferometri (højre) for at observere dens henholdsvis morfologi og væksthastigheder. Kredit:Bayer-Gir -
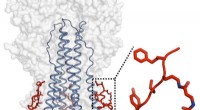 Forskere udvikler bredspektrede hæmmere af influenzavirusJanssen- og TSRI-holdene designede og karakteriserede et potent peptid, der efterlignede funktionaliteten af et bredt neutraliserende antistof, og som også var i stand til at målrette influenzavirus
Forskere udvikler bredspektrede hæmmere af influenzavirusJanssen- og TSRI-holdene designede og karakteriserede et potent peptid, der efterlignede funktionaliteten af et bredt neutraliserende antistof, og som også var i stand til at målrette influenzavirus
- De fleste kraft skal påføres, når man skubber noget over en ru overflade?
- En kunstig solsikke, der bøjer mod solen
- Hvad siger Coulombs Law, at styrken afhænger af, hvilke to anklager?
- Uventede adhæsionsegenskaber af grafen kan føre til nye nanoteknologiske enheder
- Ny krystallinsk isform:Forskere belyser krystalstruktur for eksotisk is XIX
- Hvor mange kvadratfod er der i 8 fod med 6 fod?


