Hvad er resonans i organisk kemi?
Resonans i organisk kemi:delokaliserede elektroner og stabilitet
Resonans er et afgørende koncept i organisk kemi, der hjælper os med at forstå strukturen, reaktiviteten og stabiliteten af molekyler. Den beskriver en situation, hvor faktisk struktur af et molekyle ikke kan repræsenteres af en enkelt Lewis -struktur , men snarere som en hybrid af flere bidragydende strukturer . Disse medvirkende strukturer, også kendt som resonansstrukturer, adskiller sig kun i placeringen af elektroner, især PI -elektroner og ensomme par.
Nøglekoncepter:
* delokalisering: Resonans opstår, når elektroner ikke er begrænset til et enkelt atom eller binding, men er spredt over flere atomer . Denne delokalisering er repræsenteret af buede pile viser bevægelsen af elektroner.
* Bidragende strukturer: Hver resonansstruktur er en gyldig Lewis -struktur, men ingen alene repræsenterer nøjagtigt den sande struktur af molekylet.
* resonanshybrid: Det faktiske molekyle er et vægtet gennemsnit af alle bidragende strukturer , med de mest stabile strukturer, der bidrager mere.
* stabilitet: Resonans delokalisering af elektroner stabiliserer molekyler Ved at distribuere elektrondensiteten over en større region, reducere elektronelektron-frastødning og øge systemets samlede stabilitet.
Eksempel:benzen
Benzen (C6H6) er et klassisk eksempel på resonans. Dens seks carbonatomer danner en ring med skiftende enkelt- og dobbeltbindinger. Imidlertid er den faktiske struktur af benzen en hybrid af to resonansstrukturer , hvor dobbeltbindingerne delokaliseres over hele ringen. Denne delokalisering giver benzen en unik stabilitet og forklarer dens egenskaber.
hvordan man genkender resonans:
* Tilstedeværelse af skiftende enkelt- og dobbeltobligationer: Dette antyder ofte PI -elektron -delokalisering.
* ensomme par på atomer, der støder op til dobbelt- eller tredobbelt obligationer: Disse ensomme par kan deltage i resonans.
* positive afgifter ved siden af dobbelt- eller tredobbelt obligationer: Den positive ladning kan delokaliseres ved at skifte PI -elektroner.
Betydning af resonans i organisk kemi:
* Forudsigelse af reaktivitet: Resonansstrukturer hjælper med at forudsige, hvor et molekyle mest sandsynligt reagerer.
* Forståelse af stabilitet: Molekyler med flere resonansstrukturer er generelt mere stabile.
* Forklaring af egenskaber: Resonans forklarer den usædvanlige stabilitet af visse molekyler, såsom benzen og aromatiske forbindelser.
Forståelse af resonans er vigtig for at forstå opførslen af organiske molekyler og for at forudsige deres reaktioner og egenskaber.
Sidste artikelHvilke af følgende dannede elementer er fagocytiske?
Næste artikelHvorfor klassificeres atombomber som nukleare?
 Varme artikler
Varme artikler
-
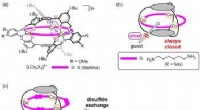 Et lukket burlignende molekyle, der kan åbnesFig.1 Oprindeligt lukket molekylærbur (til venstre). Disulfidbindinger kan brydes via reaktioner med thiolatanioner, resulterer i dannelse af åbninger (højre). Kredit:Kanazawa University Forskere
Et lukket burlignende molekyle, der kan åbnesFig.1 Oprindeligt lukket molekylærbur (til venstre). Disulfidbindinger kan brydes via reaktioner med thiolatanioner, resulterer i dannelse af åbninger (højre). Kredit:Kanazawa University Forskere -
 Nyt antibiotikum opkaldt efter LeidenErnæringsjord med en producentstamme af Streptomyces sammen med inddragelse af en enkelt koloni. Kredit:Leiden University Stigende resistens og mangel på nye antibiotika er et alvorligt problem fo
Nyt antibiotikum opkaldt efter LeidenErnæringsjord med en producentstamme af Streptomyces sammen med inddragelse af en enkelt koloni. Kredit:Leiden University Stigende resistens og mangel på nye antibiotika er et alvorligt problem fo -
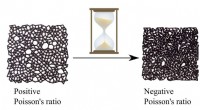 Brug af en materialehukommelse til at kode unikke fysiske egenskaberForskere har vist, at et materiales naturlige ældningsproces kan udnyttes til at skabe materialer med usædvanlige egenskaber. Kredit:Nidhi Pashine En ny undersøgelse offentliggjort i Videnskabens
Brug af en materialehukommelse til at kode unikke fysiske egenskaberForskere har vist, at et materiales naturlige ældningsproces kan udnyttes til at skabe materialer med usædvanlige egenskaber. Kredit:Nidhi Pashine En ny undersøgelse offentliggjort i Videnskabens -
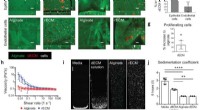 Ny bioink bringer 3D-print af menneskelige organer tættere på virkelighedenKarakterisering af rECM hybrid hydrogeler. a) Billede af alginat og mus rECM hydrogeler. Målestænger:1 mm. b) Alginat – fluorescein- og ECM – rhodamin -modificeret rECM -hydrogel, der viser fordelinge
Ny bioink bringer 3D-print af menneskelige organer tættere på virkelighedenKarakterisering af rECM hybrid hydrogeler. a) Billede af alginat og mus rECM hydrogeler. Målestænger:1 mm. b) Alginat – fluorescein- og ECM – rhodamin -modificeret rECM -hydrogel, der viser fordelinge
- Hvor lang tid tager det stjerner lys at få os?
- Teknikkyndige mennesker er mere tilbøjelige til at stole på digitale læger
- Hvordan opsatte Dmitri Mendeleev det periodiske system ved?
- Elbiler sender realtidsdata til den kinesiske regering
- Definer udtrykket hastighed. Hvad er dens forskellige enheder, er det en skalar eller vektormængde?…
- Vil du med på nanoteknologi? Drag fordel af samarbejdsmiljøer


