Hvorfor påvirker temperaturen viskositeten af en gas?
* molekylær bevægelse: Gasviskositet drives primært af momentumoverførslen mellem gasmolekyler. Ved højere temperaturer bevæger gasmolekyler sig hurtigere og kolliderer oftere. Denne øgede kollisionshastighed fører til en større udveksling af momentum, hvilket igen øger væskens modstand mod flow (dvs. viskositet).
* Gennemsnitlig fri sti: Den gennemsnitlige afstand, som et molekyle bevæger sig mellem kollisioner (gennemsnitlig fri sti), falder ved højere temperaturer. Dette skyldes, at den øgede molekylære bevægelse fører til hyppigere kollisioner. En kortere gennemsnitlig fri sti resulterer i hyppigere overførsel af momentum, hvilket bidrager til højere viskositet.
* Intermolekylære kræfter: Mens intermolekylære kræfter generelt er svagere i gasser sammenlignet med væsker, spiller de stadig en rolle, især ved lavere temperaturer. Efterhånden som temperaturen stiger, overvinder molekylernes kinetiske energi disse kræfter, hvilket giver dem mulighed for at bevæge sig mere frit og dermed mindske viskositeten.
forenklet analogi: Forestil dig et overfyldt rum. Hvis folk står stille (lav temperatur), kan de let bevæge sig rundt med minimal stød. Hvis alle løber rundt (høj temperatur), bliver det sværere at bevæge sig gennem rummet, da kollisioner er hyppigere.
Kortfattet:
* Højere temperatur =hurtigere molekylær bevægelse =flere kollisioner =højere viskositet.
* Effekten af temperatur på viskositet er et direkte forhold: Når temperaturen stiger, øges viskositeten.
Det er vigtigt at bemærke, at selvom temperaturen er en betydelig faktor, kan andre variabler som gasdensitet og molekylvægt også påvirke viskositeten.
 Varme artikler
Varme artikler
-
 Ny undersøgelse foreslår en lav pris, højeffektiv maskedesignKredit:CC0 Public Domain Et nyt papir ind Oxford Open Materials Science præsenterer billige modifikationer til eksisterende N95-masker, der forlænger deres effektivitet og forbedrer deres genanv
Ny undersøgelse foreslår en lav pris, højeffektiv maskedesignKredit:CC0 Public Domain Et nyt papir ind Oxford Open Materials Science præsenterer billige modifikationer til eksisterende N95-masker, der forlænger deres effektivitet og forbedrer deres genanv -
 Metalindustrien er ved at gennemgå en af de største omvæltninger i historien, siger ekspertPotentielt bæredygtig:i dag, elektricitet bruges allerede til elektrolytisk udvinding af aluminium fra dets malme. I dag, elektricitet kommer ofte fra vandkraftværker, men også fra konventionelle kraf
Metalindustrien er ved at gennemgå en af de største omvæltninger i historien, siger ekspertPotentielt bæredygtig:i dag, elektricitet bruges allerede til elektrolytisk udvinding af aluminium fra dets malme. I dag, elektricitet kommer ofte fra vandkraftværker, men også fra konventionelle kraf -
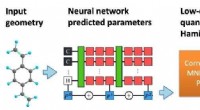 Gennembrud rapporteret inden for maskinlæringsforbedret kvantekemiModellens opbygning. Et neuralt netværk behandler en molekylær geometri for at forudsige en semi-empirisk kvante Hamiltonian, som derefter løses selvkonsekvent for at forudsige en række kemiske egensk
Gennembrud rapporteret inden for maskinlæringsforbedret kvantekemiModellens opbygning. Et neuralt netværk behandler en molekylær geometri for at forudsige en semi-empirisk kvante Hamiltonian, som derefter løses selvkonsekvent for at forudsige en række kemiske egensk -
 Udrugbare sygdomme får et nyt værktøj til opdagelse af RNA-lægemidlerScripps forskningskemiker Matthew Disney, PhD, og kandidatstuderende Blessy Suresh i deres Jupiter, Florida laboratorium. Kredit:Scripps Research Forestil dig, at du prøver at kaste et blik, når d
Udrugbare sygdomme får et nyt værktøj til opdagelse af RNA-lægemidlerScripps forskningskemiker Matthew Disney, PhD, og kandidatstuderende Blessy Suresh i deres Jupiter, Florida laboratorium. Kredit:Scripps Research Forestil dig, at du prøver at kaste et blik, når d


