Med hensyn til kinetiske molekylære teorasasser, hvordan kan øgning i temperaturen en gas, der er begrænset stiv beholder, forårsage en trykgas?
kinetisk molekylær teori Basics
* gaspartikler er i konstant, tilfældig bevægelse: De bevæger sig i lige linjer, indtil de kolliderer med hinanden eller containervæggene.
* Kollisioner er perfekt elastiske: Energi overføres under kollisioner, men ingen energi går tabt.
* ubetydelig mængde partikler: Volumenet af selve gaspartiklerne er lille sammenlignet med beholderens volumen.
* Ingen attraktive eller frastødende kræfter: Gaspartikler interagerer ikke med hinanden undtagen under kollisioner.
hvordan temperatur påvirker trykket
1. Øget kinetisk energi: Når du øger temperaturen på en gas, tilføjer du energi til dens partikler. Denne energi manifesterer sig som øget kinetisk energi , hvilket betyder, at partiklerne bevæger sig hurtigere.
2. hyppigere og kraftfulde kollisioner: Når gaspartiklerne bevæger sig hurtigere, kolliderer de hyppigere med containerens vægge og med større kraft.
3. Tryk øges: Tryk er defineret som den kraft, der udøves pr. Enhedsareal. Da kollisionerne er hyppigere og kraftfulde, øges den kraft, der udøves på beholdervæggene, hvilket fører til en stigning i trykket.
Nøglepunkter
* stiv beholder: Containeren, der er stiv, er afgørende. Hvis containeren kunne udvide, ville det øgede tryk få den til at gøre det og opretholde et relativt konstant internt tryk.
* konstant volumen: Gasvolumenet forbliver konstant, fordi beholderen ikke kan udvide. Dette betyder, at den øgede kinetiske energi direkte oversættes til en stigning i trykket.
Kortfattet
Forøgelse af temperaturen på en gas, der er begrænset i en stiv beholder, fører til en stigning i tryk, fordi gaspartiklerne bevæger sig hurtigere, hvilket resulterer i hyppigere og kraftfulde kollisioner med containervæggene.
Sidste artikelHvad er anvendelsen af Ebonite?
Næste artikelHvad fortalte guldfolie -eksperieriment forskere om atomstruktur?
 Varme artikler
Varme artikler
-
 Usædvanlig koboltforbindelse udviklet til tyndfilmproduktionKredit:Pixabay/CC0 Public Domain Et forskerhold fra Ruhr-Universität Bochum (RUB) og Carleton University i Ottawa har fremstillet en roman, meget alsidig koboltforbindelse. Forbindelsens molekyler
Usædvanlig koboltforbindelse udviklet til tyndfilmproduktionKredit:Pixabay/CC0 Public Domain Et forskerhold fra Ruhr-Universität Bochum (RUB) og Carleton University i Ottawa har fremstillet en roman, meget alsidig koboltforbindelse. Forbindelsens molekyler -
 Forskere afslører sensor, der hurtigt opdager COVID-19-infektionNår den er knyttet til understøttende elektronik, sensoren kan trådløst overføre data til brugerens mobiltelefon via Bluetooth. Kredit:Caltech Et træk ved COVID-19-virussen, der gør den så vanskel
Forskere afslører sensor, der hurtigt opdager COVID-19-infektionNår den er knyttet til understøttende elektronik, sensoren kan trådløst overføre data til brugerens mobiltelefon via Bluetooth. Kredit:Caltech Et træk ved COVID-19-virussen, der gør den så vanskel -
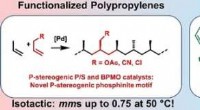 Katalysatorer for isotaktiske polære polypropylenerKredit: Angewandte Chemie International Edition Polypropylen (PP) er en af de mest anvendte plastmaterialer i verden. Ved at kontrollere den rumlige orientering af propylen -byggestenene og yde
Katalysatorer for isotaktiske polære polypropylenerKredit: Angewandte Chemie International Edition Polypropylen (PP) er en af de mest anvendte plastmaterialer i verden. Ved at kontrollere den rumlige orientering af propylen -byggestenene og yde -
 Biologer lærte infusoria at bekæmpe giftstofferAntioxidanter modvirker de negative virkninger af brintoverilte på infusorians overlevelse Paramecium caudatum . Det ses, at antioxidanterne øger overlevelsesraten for infusorian i hydrogenperoxidop
Biologer lærte infusoria at bekæmpe giftstofferAntioxidanter modvirker de negative virkninger af brintoverilte på infusorians overlevelse Paramecium caudatum . Det ses, at antioxidanterne øger overlevelsesraten for infusorian i hydrogenperoxidop
- Udforske Europa muligt med silicium-germanium-transistorteknologi
- Hvad er de naturlige ressourcer for centrale sletter?
- Hvad udøver et ladet objekt i et andet objekt?
- Forskere observerer organisk kemisk reaktion med elektronmikroskop
- Hvad sker der med en objekts orbitalhastighed, når det nærmer sig solen?
- Hvor dårligt vil Ruslands krigstorpedohåb på globalt klimasamarbejde?


