Hvorfor kan faste stoffer understøtte genstande lettere end væsker?
Her er en sammenbrud:
* stiv struktur: Faststoffer har en fast, stiv struktur, hvor molekyler er tæt pakket og holdes sammen af stærke intermolekylære kræfter. Dette betyder, at molekylerne ikke kan bevæge sig frit forbi hinanden, og den faste opretholder sin form, selv under pres.
* Stærke intermolekylære kræfter: Molekylerne i faste stoffer tiltrækkes stærkt af hinanden, hvilket skaber et sammenhængende netværk, der modstår deformation. Disse kræfter forhindrer, at det faste stof flyder og giver det mulighed for at fordele vægten af et objekt jævnt.
væsker på den anden side har en meget svagere intermolekylær attraktion.
* fluidstruktur: Væsker (væsker og gasser) har svage intermolekylære kræfter, hvilket gør det muligt for molekyler at bevæge sig frit forbi hinanden. Denne fluiditet gør dem ude af stand til at opretholde en fast form og får dem til at flyde under pres.
* Trykfordeling: Når et objekt placeres på en væske, fordeles trykket ujævnt. Væsken under objektet oplever mere tryk end væsken, der omgiver den, hvilket får væsken til at bevæge sig og sprede sig. Denne bevægelse gør det vanskeligt for væsken at understøtte objektets vægt.
Sammenfattende er den vigtigste forskel styrken af de intermolekylære kræfter og stivheden af strukturen. Faststoffer har stærke kræfter og en stiv struktur, hvilket giver dem mulighed for at modstå pres og understøtte genstande. Væsker har svage kræfter og en fleksibel struktur, hvilket gør dem ikke i stand til at understøtte genstande som effektivt.
Sidste artikelHvad er ligningen for beta-forfald af uran-237?
Næste artikelHvilke ioner har flere elektroner end protoner?
 Varme artikler
Varme artikler
-
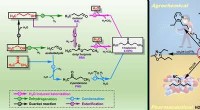 Forskere fremmer biomassetransformationsprocessen(A) Dette er en foreslået reaktionsvej, der fører til 4-HPO. (B) Dette er 4-HPO-udnyttelse. Kredit:DICP Biomasse kan tjene som en vedvarende kilde til både energi og kulstof. Acetone, n-butanol, o
Forskere fremmer biomassetransformationsprocessen(A) Dette er en foreslået reaktionsvej, der fører til 4-HPO. (B) Dette er 4-HPO-udnyttelse. Kredit:DICP Biomasse kan tjene som en vedvarende kilde til både energi og kulstof. Acetone, n-butanol, o -
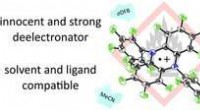 Kemikere producerer nye oxidanter som et værktøj til præparativ kemiKredit: Angewandte Chemie (2020). DOI:10.1002/ange.202002768 Kemisk oxidation, selektiv fjernelse af elektroner fra et substrat, repræsenterer en af de vigtigste transformationer i kemi. Imidle
Kemikere producerer nye oxidanter som et værktøj til præparativ kemiKredit: Angewandte Chemie (2020). DOI:10.1002/ange.202002768 Kemisk oxidation, selektiv fjernelse af elektroner fra et substrat, repræsenterer en af de vigtigste transformationer i kemi. Imidle -
 Hvad er sjældne jordarters grundstoffer? Fire spørgsmål besvaretEn håndfuld europium. Kredit:Alchemist-hp, CC BY-SA De fleste amerikanere bruger sjældne jordarters grundstoffer hver dag – uden at vide det, eller ved noget om, hvad de laver. Det kan ændre sig,
Hvad er sjældne jordarters grundstoffer? Fire spørgsmål besvaretEn håndfuld europium. Kredit:Alchemist-hp, CC BY-SA De fleste amerikanere bruger sjældne jordarters grundstoffer hver dag – uden at vide det, eller ved noget om, hvad de laver. Det kan ændre sig, -
 Grøn funktionalisering af kulstof-brintbindingerProf Wu og hans medarbejdere diskuterer organiske molekylære transformationsprocesser i deres laboratorium. De har udviklet en grøn proces, som gør brug af lys til at funktionalisere organiske molekyl
Grøn funktionalisering af kulstof-brintbindingerProf Wu og hans medarbejdere diskuterer organiske molekylære transformationsprocesser i deres laboratorium. De har udviklet en grøn proces, som gør brug af lys til at funktionalisere organiske molekyl
- Coronavirus er vigtigt, men det er en sand sort svanebegivenhed?
- Maskinindlæringsteknik giver indsigt i plasmeadfærd
- Ville et stof med en pH-værdi på 2 være meget surt eller basisk?
- Psykolog diskuterer, hvordan #metoo skaber solidaritet for ofre for seksuel chikane
- Billede:Solen i 2020
- Hvor hurtigt er hypersonisk hastighed?


