Beskriv som en række trin, hvordan bordsalt i vand gør løsning, der kan udføre elektricitet?
1. Opløsning af salt:
* ioniske forbindelser: Tabel salt er en ionisk forbindelse, hvilket betyder, at den dannes af den elektrostatiske tiltrækning mellem positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-).
* vand som opløsningsmiddel: Vand er et polært opløsningsmiddel, hvilket betyder, at dets molekyler har en lidt positiv ende og en lidt negativ ende. Denne polaritet tillader vandmolekyler at omringe og tiltrække de ladede ioner i salt.
* dissociation: Vandmolekylerne trækker Na+ og kloderne fra hinanden og bryder de ioniske bindinger, der holdt dem sammen i saltkrystallen. Disse ioner er nu frie til at bevæge sig rundt i vandet.
2. Oprettelse af en ledende vej:
* Mobilafgiftsselskaber: De opløste Na+ og Cl- ioner i vandet bliver mobile ladningsselskaber. De kan bevæge sig frit gennem løsningen.
* Elektrisk strøm: Når et elektrisk potentiale (en spænding) påføres på tværs af saltopløsningen, svarer ionerne:
* Positive Na+ -ioner bevæger sig mod den negative elektrode (katode).
* Negative kloder bevæger sig mod den positive elektrode (anode).
* flow af ladning: Denne bevægelse af ioner udgør en elektrisk strøm. Løsningen er nu i stand til at udføre elektricitet.
Kortfattet:
* Opløsningen af salt i vand skaber frit bevægende ioner.
* Disse ioner fungerer som ladningsbærere, hvilket giver mulighed for strøm af elektricitet, når der påføres en spænding.
Vigtig note: Rent vand i sig selv er en meget dårlig leder af elektricitet. Det er tilstedeværelsen af opløste ioner (som dem fra salt), der gør opløsningen ledende.
 Varme artikler
Varme artikler
-
 At se kemiske reaktioner med musik(Top) Lydkontrollerede spatiotemporale mønstre. Skematisk repræsentation af eksperimentel opsætning brugt til lydstyret spatiotemporal mønstergenerering. For mønstergenereringseksperimenter, O2-følsom
At se kemiske reaktioner med musik(Top) Lydkontrollerede spatiotemporale mønstre. Skematisk repræsentation af eksperimentel opsætning brugt til lydstyret spatiotemporal mønstergenerering. For mønstergenereringseksperimenter, O2-følsom -
 Inde i brændselscellen:Imaging metode lover industriel indsigtHydrogenholdige stoffer er vigtige for mange industrier, men forskere har kæmpet for at få detaljerede billeder for at forstå elementets adfærd. I gennemgang af videnskabelige instrumenter, forskere d
Inde i brændselscellen:Imaging metode lover industriel indsigtHydrogenholdige stoffer er vigtige for mange industrier, men forskere har kæmpet for at få detaljerede billeder for at forstå elementets adfærd. I gennemgang af videnskabelige instrumenter, forskere d -
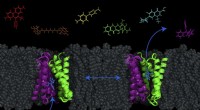 Ny model afslører muligheden for at pumpe antibiotika ind i bakterierEt transportørprotein - kaldet EmrE, vist i lilla og grønt -- i cellemembranen af E. coli kan bakterier skiftes mellem to konformationer for at pumpe molekyler (såsom antibakterielle lægemidler) ud
Ny model afslører muligheden for at pumpe antibiotika ind i bakterierEt transportørprotein - kaldet EmrE, vist i lilla og grønt -- i cellemembranen af E. coli kan bakterier skiftes mellem to konformationer for at pumpe molekyler (såsom antibakterielle lægemidler) ud -
 Asteroide-nedslag skaber diamantmaterialer med usædvanligt komplekse strukturerKredit:Pixabay/CC0 Public Domain Stødbølger forårsaget af asteroider, der kolliderer med Jorden, skaber materialer med en række komplekse kulstofstrukturer, som kan bruges til at fremme fremtidige
Asteroide-nedslag skaber diamantmaterialer med usædvanligt komplekse strukturerKredit:Pixabay/CC0 Public Domain Stødbølger forårsaget af asteroider, der kolliderer med Jorden, skaber materialer med en række komplekse kulstofstrukturer, som kan bruges til at fremme fremtidige
- Sådan Lær at Læs Surface Mount Kondensatorer
- Ultratynde sølvfilm og litografisk mønstrede strukturer for at forbedre plasmonisk ydeevne
- Ville oplysningen have fundet sted uden videnskabelig revolution?
- Håbets stråle? Et sted, hvor revmanta-rokker trives
- Identificer de to informationsstykker, du har brug for at kende hastighed et objekt?
- Restaurantlevering bliver lettere for de fleste, men ikke Grubhub


