Hvorfor ændres ikke temperaturen under staten fra fast til væske?
1. Temperaturen forbliver konstant under faseændringen, men det betyder ikke, at energien ikke ændrer sig.
* Under en faseændring bruges den varmeenergi, der absorberes af stoffet, til at bryde bindingerne mellem molekyler i stedet for at øge molekylernes kinetiske energi (hvilket ville manifestere sig som en temperaturstigning).
* Denne energi kaldes latent fusionsvarme , og det repræsenterer den energi, der kræves for at ændre stoftilstanden fra fast stof til væske ved en konstant temperatur.
2. Temperaturen ændres før og efter faseændringen.
* Før det faste stof begynder at smelte, øges temperaturen, når stoffet absorberer varmen.
* Efter at det faste stof er helt smeltet, vil væskens temperatur fortsat stige, når den absorberer mere varme.
Her er en analogi:
Forestil dig en gryde med vand på komfuret. Når du opvarmer vandet, øges dens temperatur, indtil det når 100 ° C (212 ° F). På dette tidspunkt begynder vandet at koge. Selvom du fortsætter med at tilsætte varme, forbliver vandets temperatur konstant ved 100 ° C, indtil alt vandet er blevet til damp. Den energi, du tilføjer, bruges til at bryde bindingerne mellem vandmolekyler, så de kan flygte ud i luften som damp. Når alt vandet er væk, vil temperaturen på dampen begynde at stige igen, hvis du fortsætter med at opvarme det.
Konklusion:
Temperaturen forbliver konstant under en faseændring, fordi den tilsatte energi bruges til at ændre stoftilstanden, ikke til at øge molekylernes kinetiske energi. Denne energi kaldes den latente fusionsvarme. Temperaturen ændres før og efter faseændringen.
Sidste artikelHvad ville der ske i en atomreaktor, hvis kølevæskevæsken lækkede?
Næste artikelHvad gør molekyler for at gøre det kolde?
 Varme artikler
Varme artikler
-
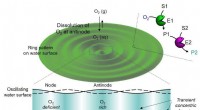 Spatiotemporal regulering af kemiske reaktioner ved kun at bruge hørbar lydFigur 1. Hørbar lydinduceret generering af transiente domæner og spatiotemporalt kontrollerede kaskadereaktionsnetværk. Kredit:Institut for Grundvidenskab Spatiotemporal regulering af flertrins enz
Spatiotemporal regulering af kemiske reaktioner ved kun at bruge hørbar lydFigur 1. Hørbar lydinduceret generering af transiente domæner og spatiotemporalt kontrollerede kaskadereaktionsnetværk. Kredit:Institut for Grundvidenskab Spatiotemporal regulering af flertrins enz -
 Ny tilgang skaber en enestående enkeltatomskatalysator til vandopdelingEn illustration viser et nyt system udviklet på SLAC og Stanford, der forankrer individuelle iridiumatomer til overfladen af en katalysator, øger dens effektivitet ved spaltning af vand til rekordni
Ny tilgang skaber en enestående enkeltatomskatalysator til vandopdelingEn illustration viser et nyt system udviklet på SLAC og Stanford, der forankrer individuelle iridiumatomer til overfladen af en katalysator, øger dens effektivitet ved spaltning af vand til rekordni -
 Spor af opiater fundet i antikke cypriotiske fartøjerBase-ring juglet ligner frøhovedet af en opiumsvalmue Kredit:British Museum Forskere ved University of York og British Museum har opdaget spor af opiater, der er bevaret inde i et karakteristisk k
Spor af opiater fundet i antikke cypriotiske fartøjerBase-ring juglet ligner frøhovedet af en opiumsvalmue Kredit:British Museum Forskere ved University of York og British Museum har opdaget spor af opiater, der er bevaret inde i et karakteristisk k -
 Nyt ledende polymerblæk åbner for næste generation af trykt elektronikForskere ved Linköpings Universitet, Sverige, har udviklet et stabilt polymerblæk med høj ledningsevne. Det nye n-type materiale kommer i form af blæk med ethanol som opløsningsmiddel. Kredit:Thor Bal
Nyt ledende polymerblæk åbner for næste generation af trykt elektronikForskere ved Linköpings Universitet, Sverige, har udviklet et stabilt polymerblæk med høj ledningsevne. Det nye n-type materiale kommer i form af blæk med ethanol som opløsningsmiddel. Kredit:Thor Bal
- Cichlidefiskes nysgerrighed fremmer biodiversitet:Hvordan udforskende adfærd hjælper med økologis…
- Privatiserede fængsler fører til flere indsatte, længere sætninger, undersøgelse finder
- Fordele og ulemper ved Bacillus Expressions System
- Usædvanlig doughnut-formet jet observeret i galaksen NGC 6109
- Hvem opdagede Super Atom eller Bec?
- Fiskeri efter plast på Amsterdams miljøvenlige kanalcruise


