Hvilket udvider mere flydende eller gas?
Forklaring:
* Intermolekylære kræfter: Gasser har meget svagere intermolekylære kræfter end væsker. Dette betyder, at molekylerne i en gas er langt længere fra hinanden og har mere frihed til at bevæge sig rundt.
* kinetisk energi: Gasmolekyler har højere kinetisk energi end flydende molekyler. Dette betyder, at de bevæger sig hurtigere og kolliderer med hinanden hyppigere, hvilket fører til større ekspansion.
* Kompressibilitet: Gasser er meget komprimerbare, hvilket betyder, at deres volumen let kan reduceres ved at anvende tryk. Væsker er mindre komprimerbare.
Eksempel:
Forestil dig en ballon fyldt med luft. Når du opvarmer luften inde i ballonen, får gasmolekylerne kinetisk energi og bevæger sig hurtigere. De kolliderer hyppigere med ballonens vægge, hvilket får ballonen til at udvide sig.
Konklusion:
På grund af deres svagere intermolekylære kræfter, højere kinetisk energi og kompressibilitet, udvides gasser markant mere end væsker, når de opvarmes eller udsættes for ændringer i tryk.
 Varme artikler
Varme artikler
-
 Video:Hvad gør gerningsstedsefterforskere egentlig?Kredit:The American Chemical Society Tv-krimidramaer har et stort publikum, men deres popularitet har fået nogle uventede konsekvenser. De har skabt interesse for retsmedicin, men de har også for
Video:Hvad gør gerningsstedsefterforskere egentlig?Kredit:The American Chemical Society Tv-krimidramaer har et stort publikum, men deres popularitet har fået nogle uventede konsekvenser. De har skabt interesse for retsmedicin, men de har også for -
 Hvad er sjældne jordarters grundstoffer? Fire spørgsmål besvaretEn håndfuld europium. Kredit:Alchemist-hp, CC BY-SA De fleste amerikanere bruger sjældne jordarters grundstoffer hver dag – uden at vide det, eller ved noget om, hvad de laver. Det kan ændre sig,
Hvad er sjældne jordarters grundstoffer? Fire spørgsmål besvaretEn håndfuld europium. Kredit:Alchemist-hp, CC BY-SA De fleste amerikanere bruger sjældne jordarters grundstoffer hver dag – uden at vide det, eller ved noget om, hvad de laver. Det kan ændre sig, -
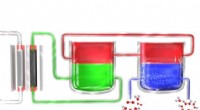 Ny proces kunne gøre brintoverilte tilgængelig på fjerntliggende stederI en ny metode til at producere hydrogenperoxid bærbart, en elektrolysator (til venstre) spalter vand til brint og ilt. Brintatomerne dannes oprindeligt i et elektrolytmateriale (grønt), som overfører
Ny proces kunne gøre brintoverilte tilgængelig på fjerntliggende stederI en ny metode til at producere hydrogenperoxid bærbart, en elektrolysator (til venstre) spalter vand til brint og ilt. Brintatomerne dannes oprindeligt i et elektrolytmateriale (grønt), som overfører -
 Indstilling af en TRAP for pandemi-fremkaldende viraTRAP-visningsmetoden fisker efter syntetiske proteiner fra et bibliotek af billioner efter dem, der kan målrette mod SARS-CoV-2. Tilgangen var i stand til at identificere proteiner, der kan bruges til
Indstilling af en TRAP for pandemi-fremkaldende viraTRAP-visningsmetoden fisker efter syntetiske proteiner fra et bibliotek af billioner efter dem, der kan målrette mod SARS-CoV-2. Tilgangen var i stand til at identificere proteiner, der kan bruges til
- Hvad er den fjerde lyseste planet på himlen?
- Hvilken type makromolekyle udfører følgende funktioner Energilagringsstruktur er det en kulhydratp…
- Hvilken energitransformation finder sted i et faldende objekt?
- Hvorfor er relativitetsteori vigtig?
- Hvad er Lewis -struktur for brintsulfid?
- Video:Sentinel-6 mission


