Hvordan påvirker elektroner formen på et molekyle?
1. Valenselektroner og binding:
* Elektroner i den yderste skal (valenselektroner) er involveret i kemisk binding. De danner bindinger med andre atomer for at opnå en stabil elektronkonfiguration.
* Den dannede bindingstype afhænger af antallet af valenselektroner og elektronegativiteten af de involverede atomer. For eksempel involverer en enkelt binding et delt elektronpar, en dobbeltbinding involverer to delte elektronpar osv.
2. Elektronafvisning og VSEPR -teori:
* Valence Shell Electron Pair Repulsion (VSEPR) teori siger, at elektronpar (både binding og ikke-bonding) omkring et centralt atom vil arrangere sig for at minimere frastødelse. Dette arrangement fører til specifikke molekylformer.
* Ensomme par elektroner (ikke-bindende par) udøver stærkere frastødelse end bindingspar. Dette skyldes, at ensomme par er lokaliseret omkring det centrale atom, hvorimod bindingspar deles mellem to atomer.
3. Hybridisering:
* I nogle tilfælde kan atomiske orbitaler hybridisere til at danne nye hybrid orbitaler, der er mere egnede til binding.
* Antallet og arrangementet af hybrid orbitaler bestemmer formen på molekylet. For eksempel fører SP3 -hybridisering til tetrahedral geometri, SP2 -hybridisering fører til trigonal plan geometri og så videre.
4. Molekylær geometri og bindingsvinkler:
* Arrangementet af atomer i et molekyle kaldes dets molekylære geometri.
* Vinklerne mellem bindinger i et molekyle kaldes bindingsvinkler.
* Både molekylær geometri og bindingsvinkler påvirkes af elektronparene omkring det centrale atom.
Eksempler:
* vand (H2O): Oxygen har to ensomme par og to bindingspar elektroner. VSEPR -teorien forudsiger en bøjet form med en bindingsvinkel på ca. 104,5 °.
* methan (CH4): Carbon har fire bindingspar elektroner. VSEPR -teorien forudsiger en tetrahedral form med bindingsvinkler på 109,5 °.
* kuldioxid (CO2): Carbon har to dobbeltbindinger med iltatomer. VSEPR -teorien forudsiger en lineær form med bindingsvinkler på 180 °.
Afslutningsvis bestemmer arrangementet af elektroner omkring et atom formen af et molekyle. Ved at forstå principperne for VSEPR -teori og hybridisering kan vi forudsige og forklare formerne for forskellige molekyler.
 Varme artikler
Varme artikler
-
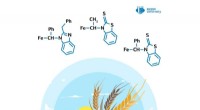 Kemiker skaber stoffer, der stimulerer plantevækstKredit:RUDN Universitet En kemiker fra RUDN University har opnået biologisk aktive derivater af ferrocen, som stimulerer plantevæksten med 67 % og beskytter dem mod herbicider. Artiklen blev publi
Kemiker skaber stoffer, der stimulerer plantevækstKredit:RUDN Universitet En kemiker fra RUDN University har opnået biologisk aktive derivater af ferrocen, som stimulerer plantevæksten med 67 % og beskytter dem mod herbicider. Artiklen blev publi -
 Undgåelige forbindelser af drivhusgasser isoleretKredit:University of Warwick Dinitrogenoxid (N 2 O) er et potent atmosfærisk forurenende stof. Selvom det forekommer naturligt, menneskeskabte N 2 O -emissioner fra intensiv landbrugsgødskning
Undgåelige forbindelser af drivhusgasser isoleretKredit:University of Warwick Dinitrogenoxid (N 2 O) er et potent atmosfærisk forurenende stof. Selvom det forekommer naturligt, menneskeskabte N 2 O -emissioner fra intensiv landbrugsgødskning -
 Tre forskere vinder Nobelprisen i kemi for udviklingen inden for elektronmikroskopiEn revolutionerende teknik kaldet kryo-elektronmikroskopi, som har set nærmere på Zika -viruset og et Alzheimers enzym, tjente forskere Jacques Dubochet, Joachim Frank og Richard Henderson Nobels kemi
Tre forskere vinder Nobelprisen i kemi for udviklingen inden for elektronmikroskopiEn revolutionerende teknik kaldet kryo-elektronmikroskopi, som har set nærmere på Zika -viruset og et Alzheimers enzym, tjente forskere Jacques Dubochet, Joachim Frank og Richard Henderson Nobels kemi -
 Røget mad er mere velsmagende, mindre skadeligt med et tip fra bilindustrienKredit:CC0 Public Domain Infusion af fødevarer med røg kan give lækre nuancerede smage, men kan også komme med en uvelkommen side af kræftfremkaldende stoffer. For at reducere kræftfremkaldende in
Røget mad er mere velsmagende, mindre skadeligt med et tip fra bilindustrienKredit:CC0 Public Domain Infusion af fødevarer med røg kan give lækre nuancerede smage, men kan også komme med en uvelkommen side af kræftfremkaldende stoffer. For at reducere kræftfremkaldende in
- Hvad er forskellen i ikke -metal og stoffer smeltepunkter?
- Har væsker elektrisk ladede partikler?
- Hvad er en kemisk reaktion, og hvordan er reaktantersprodukter involveret?
- Et scannende kvantesansende mikroskop med nanoskala elektrisk felt-billeddannelse
- Særegen fysik på arbejde i hjernen
- Californiens naturbrandforurening lammer San Francisco-regionen


