Hvorfor udvides de fleste faste stoffer ved opvarmning?
1. Øget kinetisk energi:
* Når der påføres varme på et fast stof, absorberes energien af atomer eller molekyler inden for det faste stof.
* Denne absorberede energi øger disse partiklers kinetiske energi, hvilket får dem til at vibrere mere kraftigt.
* Denne øgede vibration resulterer i en større gennemsnitlig separationsafstand mellem partiklerne.
2. Intermolekylære kræfter:
* Atomer eller molekyler i et fast stof holdes sammen af intermolekylære kræfter (som van der Waals -kræfter, ioniske bindinger eller kovalente bindinger).
* Disse kræfter er ikke stive, men har en vis elasticitet.
* Når vibrationerne øges, strækker disse kræfter sig, så partiklerne kan bevæge sig længere fra hinanden.
3. Termisk ekspansion:
* Stigningen i den gennemsnitlige separationsafstand mellem partikler fører til en samlet stigning i mængden af det faste stof. Dette er kendt som termisk ekspansion.
* Udvidelsen er normalt ret lille til faste stoffer, men den er betydelig nok til at blive observeret i mange applikationer.
4. Undtagelser:
* Mens de fleste faste stoffer udvides ved opvarmning, udviser nogle usædvanlig opførsel. For eksempel udvides vand ved frysning på grund af dannelsen af en åben krystallinsk struktur.
Kortfattet: Den øgede kinetiske energi af partiklerne i et fast stof, der får dem til at vibrere mere og skubbe mod de intermolekylære kræfter, resulterer i øget adskillelsesafstand og den samlede ekspansion af det faste stof.
Sidste artikelHvilken bølge kan forårsage skadelige kemiske ændringer i celler?
Næste artikelHvad er emissionsspektre?
 Varme artikler
Varme artikler
-
 Nye værktøjer til at skabe spejlede former for molekylerGregory Fu og Zhaobin Wang hos Caltech. Kredit:Caltech En af de største udfordringer, som syntetiske kemikere står over for, er, hvordan man laver molekyler af kun en bestemt håndhævelse. Molekyle
Nye værktøjer til at skabe spejlede former for molekylerGregory Fu og Zhaobin Wang hos Caltech. Kredit:Caltech En af de største udfordringer, som syntetiske kemikere står over for, er, hvordan man laver molekyler af kun en bestemt håndhævelse. Molekyle -
 Sammensmeltet billedbehandling afslører skrift fra det sjette århundrede skjult inde i bogbindingEfter at have været skjult i århundreder, hemmelighederne i middelalderlige manuskripter kan snart komme frem i lyset. Ved at fusionere to billeddannelsesteknikker - synlig hyperspektral billeddannel
Sammensmeltet billedbehandling afslører skrift fra det sjette århundrede skjult inde i bogbindingEfter at have været skjult i århundreder, hemmelighederne i middelalderlige manuskripter kan snart komme frem i lyset. Ved at fusionere to billeddannelsesteknikker - synlig hyperspektral billeddannel -
 Fødevareforskere sigter mod at gøre plantebaseret protein smagere og sundereDavid Julian McClements er en fremtrædende professor i fødevarevidenskab ved UMass Amherst. Kredit:UMass Amherst I takt med at kødspisningen fortsætter med at stige rundt om i verden, fødevarefors
Fødevareforskere sigter mod at gøre plantebaseret protein smagere og sundereDavid Julian McClements er en fremtrædende professor i fødevarevidenskab ved UMass Amherst. Kredit:UMass Amherst I takt med at kødspisningen fortsætter med at stige rundt om i verden, fødevarefors -
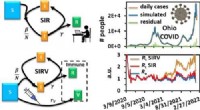 Kemi-laboratoriestuderende forudsiger spredning af COVID-19 med kinetikmodellerI denne graf forudsagde studerende i forårets kinetiklaboratorium daglige tilfælde i staten Ohio til efteråret 2022. Kredit:Ohio University Kemiker Jixin Chen så på den hurtige spredning af COVID-1
Kemi-laboratoriestuderende forudsiger spredning af COVID-19 med kinetikmodellerI denne graf forudsagde studerende i forårets kinetiklaboratorium daglige tilfælde i staten Ohio til efteråret 2022. Kredit:Ohio University Kemiker Jixin Chen så på den hurtige spredning af COVID-1
- Jordens klimalivshistorie, 3 milliarder år undervejs
- Arktisk opvarmning tre gange hurtigere end planeten, rapport advarer
- Har enzymer høje energiobligationer?
- Hvad er strukturen og placeringen af DNA i eukaryoter?
- Hvilke genstande kan stoppe gammastråler?
- Udforsker sojasovs saltforbedrende peptider


