Hvorfor bevæger molekyler af fast fast hurtigt?
Her er hvorfor:
* Stærke intermolekylære kræfter: Faststoffer har stærke intermolekylære kræfter, der holder molekylerne tæt sammen i en fast, stiv struktur. Disse kræfter begrænser bevægelsen af molekyler.
* vibrationsbevægelse: Mens molekyler i faste stoffer ikke bevæger sig frit, vibrerer de omkring deres faste positioner. Denne vibration er det, der giver faste stoffer deres stivhed og struktur.
* begrænset translationel bevægelse: Molekylerne i et fast stof kan ikke bevæge sig frit fra en position til en anden som molekyler i væsker eller gasser. De kan kun vibrere.
Tænk på det på denne måde: Forestil dig en mængde mennesker pakket tæt sammen på en koncert. De kan ikke bevæge sig frit, men de kan stadig bevæge deres arme og ben, ligesom molekyler i en fast vibration.
Kontrast dette med:
* væsker: Molekyler i væsker har svagere intermolekylære kræfter og kan bevæge sig mere frit, hvilket giver væsker deres evne til at flyde.
* Gasser: Molekyler i gasser har meget svage intermolekylære kræfter, hvilket giver dem mulighed for at bevæge sig meget hurtigt og besætte hele volumenet af deres beholder.
 Varme artikler
Varme artikler
-
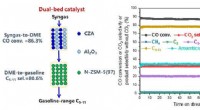 Dobbelts katalysator muliggør høj omdannelse af syngas til flydende carbonhydrider i benzininterva…Skematisk diagram for omdannelsen af syngas til flydende carbonhydrider i benzinområdet over en dobbeltbedskatalysator (CZA+Al2O3)/N-ZSM-5(97) og resultaterne af stabilitetstesten. Kredit:DICP B
Dobbelts katalysator muliggør høj omdannelse af syngas til flydende carbonhydrider i benzininterva…Skematisk diagram for omdannelsen af syngas til flydende carbonhydrider i benzinområdet over en dobbeltbedskatalysator (CZA+Al2O3)/N-ZSM-5(97) og resultaterne af stabilitetstesten. Kredit:DICP B -
 Værktøjssæt:Brug af lokal jord til 3D-print af store strukturer(A) Illustration af geopolymerisationstilgang udviklet til at størkne moskus til en bærende silikatkomposit, som repræsenteret ved kraften af et bildæk på vej forstærket af kompositmaterialet, genop
Værktøjssæt:Brug af lokal jord til 3D-print af store strukturer(A) Illustration af geopolymerisationstilgang udviklet til at størkne moskus til en bærende silikatkomposit, som repræsenteret ved kraften af et bildæk på vej forstærket af kompositmaterialet, genop -
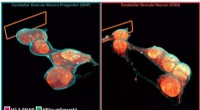 Mikroskopiteknik afslører cellers 3-D ultrastruktur i nye detaljerInde i en celle, tentakler vesikler shuttle last til sortering. DNA omarrangeres i kernen, efterhånden som stamceller differentieres til neuroner. Naboneuroner klamrer sig til hinanden gennem en web-l
Mikroskopiteknik afslører cellers 3-D ultrastruktur i nye detaljerInde i en celle, tentakler vesikler shuttle last til sortering. DNA omarrangeres i kernen, efterhånden som stamceller differentieres til neuroner. Naboneuroner klamrer sig til hinanden gennem en web-l -
 Vandledninger kan spille en større rolle i cellulær funktionKredit:CC0 Public Domain Hver af vores celler er omgivet af en kompleks membran, der fungerer som en biologisk grænse, lade ioner og næringsstoffer som salt, kalium og sukker ind og ud. Beskyttern
Vandledninger kan spille en større rolle i cellulær funktionKredit:CC0 Public Domain Hver af vores celler er omgivet af en kompleks membran, der fungerer som en biologisk grænse, lade ioner og næringsstoffer som salt, kalium og sukker ind og ud. Beskyttern
- Hvad forårsagede jorderosion på de store sletter i 1930'erne?
- Sådan Find Vinkelret Hældning
- Kvanteteori til at manipulere nanomagneter
- Hvilken af følgende beskriver bedst kinetisk teori?
- Konvertering af kropsvarme til elektricitet:Et skridt nærmere mod højtydende organisk termoelektri…
- 8 super seje genetiske mutationer fundet hos mennesker


