Hvilken slags kraft fungerer inden for et molekyle?
Der er to hovedtyper af intramolekylære kræfter:
1. kovalente obligationer: Dette er den stærkeste type intramolekylær kraft. De involverer deling af elektroner mellem atomer. Kovalente bindinger dannes, når to atomer deler elektroner i deres yderste skal for at opnå stabilitet.
2. ioniske bindinger: Dette er elektrostatiske tiltrækningskræfter mellem modsat ladede ioner. En ionisk binding dannes, når et atom mister elektroner for at blive en positivt ladet ion (kation), og et andet atom får elektroner til at blive en negativt ladet ion (anion). De modsatte anklager tiltrækker hinanden.
Her er en sammenbrud:
* kovalente obligationer: Disse bindinger er typisk stærke og ansvarlige for dannelsen af molekyler som vand (H2O), methan (CH4) og kuldioxid (CO2).
* ioniske bindinger: Disse bindinger er også stærke og ansvarlige for dannelsen af salte som natriumchlorid (NaCl).
Nøglepunkter:
* Intramolekylære kræfter er stærkere end intermolekylære kræfter, som er de kræfter, der findes mellem molekyler.
* Styrken af intramolekylære kræfter bestemmer stabiliteten og egenskaberne af et molekyle.
* Intramolekylære kræfter er ansvarlige for mange af de fysiske og kemiske egenskaber ved stoffer, såsom smeltepunkt, kogepunkt og reaktivitet.
Fortæl mig, hvis du gerne vil have mere information om en bestemt type intramolekylær kraft eller dens indflydelse på molekylære egenskaber!
Sidste artikelEr thorium udsender en beta -partikelskemisk reaktion?
Næste artikelHvilke materialer kan klassificeres som leder?
 Varme artikler
Varme artikler
-
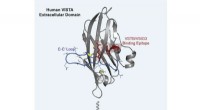 Ny indsigt i et kræftbeskyttende protein kan guide en ny generation af kræftbehandlingerVed hjælp af en kombination af beregning og eksperiment, forskere var i stand til at kortlægge formen på VISTA, et checkpoint protein, der forsvarer kræftceller mod immunsystemangreb, samt den del af
Ny indsigt i et kræftbeskyttende protein kan guide en ny generation af kræftbehandlingerVed hjælp af en kombination af beregning og eksperiment, forskere var i stand til at kortlægge formen på VISTA, et checkpoint protein, der forsvarer kræftceller mod immunsystemangreb, samt den del af -
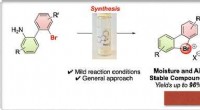 Cykliske hypervalente brom virker som aryne forstadierKredit:Wiley Diaryl λ 3 -bromaner er en sjælden og generelt uforsket klasse af forbindelser. En mild og effektiv protokol leverer nu en bred palet af disse interessante byggesten til organisk sy
Cykliske hypervalente brom virker som aryne forstadierKredit:Wiley Diaryl λ 3 -bromaner er en sjælden og generelt uforsket klasse af forbindelser. En mild og effektiv protokol leverer nu en bred palet af disse interessante byggesten til organisk sy -
 Forsker sætter fokus på plaque-fremkaldende protein ved ALS og demensSaint Louis University assisterende professor i biokemi og molekylærbiologi Yuna Ayala, Ph.D., (i midten) og medlemmer af hendes forskerhold. Kredit:Saint Louis University I et nyligt papir offent
Forsker sætter fokus på plaque-fremkaldende protein ved ALS og demensSaint Louis University assisterende professor i biokemi og molekylærbiologi Yuna Ayala, Ph.D., (i midten) og medlemmer af hendes forskerhold. Kredit:Saint Louis University I et nyligt papir offent -
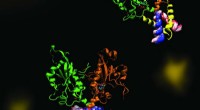 En molekylær dans af fosfolipidsynteseCCT er et nøgleenzym, der opretholder en afbalanceret sammensætning af cellemembranfosfolipider. Billedet fremhæver dynamikken i en del af enzymet CCT, der er afgørende for regulering af dets funktion
En molekylær dans af fosfolipidsynteseCCT er et nøgleenzym, der opretholder en afbalanceret sammensætning af cellemembranfosfolipider. Billedet fremhæver dynamikken i en del af enzymet CCT, der er afgørende for regulering af dets funktion


