Hvordan ruster metal?
1. Oxygen og vand: Rust dannes, når jern reagerer med ilt og vand. Dette er grunden til, at rustning er mere almindelig i fugtige eller våde miljøer.
2. Elektrokemisk reaktion: Processen involverer en elektrokemisk reaktion, hvor jern fungerer som en anode og mister elektroner og danner jernioner (Fe²⁺).
3. Dannelse af jernoxid: Disse jernioner reagerer med ilt og vand for at danne jernoxid (Fe₂o₃), som vi kender som rust. Dette er en hydreret form for jernoxid, hvilket betyder, at det indeholder vandmolekyler.
4. Rustcyklussen: Rust er porøs og flassende, hvilket giver ilt og vand mulighed for at fortsætte med at trænge ind i jernoverfladen og fremskynde rusten. Dette skaber en cyklus, hvor flere og flere jern konverteres til rust.
faktorer, der påvirker rustning:
* Fugtighed: Højere luftfugtighed øger rusten.
* Temperatur: Varmere temperaturer fremskynder de kemiske reaktioner, der er involveret i rustning.
* salt: Saltvand accelererer rustende, fordi det tilvejebringer elektrolytter, der letter den elektrokemiske reaktion.
* syrer: Syrer kan også bidrage til rustning ved at øge hastigheden af jernoxidation.
* urenheder: Jernlegeringer med andre metaller kan øge eller mindske rusten afhængigt af typen og mængden af urenheder.
Forebyggelse af rust:
* Beskyttelsesbelægninger: Påføring af maling, olie eller andre beskyttelsesbelægninger skaber en barriere mellem jernet og miljøet.
* galvanisering: Belægningsjern med zink (galvanisering) giver offerbeskyttelse som zinkkorroder i stedet for jernet.
* legering: Blanding af jern med andre metaller, såsom krom, nikkel eller mangan, kan øge dens modstand mod rust.
* katodisk beskyttelse: Brug af et mere elektrokemisk aktivt metal, som magnesium, for at forhindre korrosion af jernet.
Rusting er en kompleks proces, men at forstå, hvordan det fungerer, hjælper os med at finde effektive måder til at forhindre det og beskytte vores jernstrukturer og produkter.
Sidste artikelHvad er den kemiske ligning for lactose og lactase?
Næste artikelHvem opdagede gas?
 Varme artikler
Varme artikler
-
 Vandfri måde at lave MXenes på kan betyde nye anvendelser for de lovende nanomaterialerDrexel University forskere har udviklet en måde at producere de lovende 2D nanomaterialer, MXenes, uden at bruge vand. Dette gør det muligt for materialerne at blive brugt til applikationer som energi
Vandfri måde at lave MXenes på kan betyde nye anvendelser for de lovende nanomaterialerDrexel University forskere har udviklet en måde at producere de lovende 2D nanomaterialer, MXenes, uden at bruge vand. Dette gør det muligt for materialerne at blive brugt til applikationer som energi -
 Forståelse af enzymudvikling baner vejen for grøn kemiLaboratorieudvikling af et designerenzym gør det til en meget bedre katalysator. Simuleringer viser, at evolutionen gør dette ved at indføre netværk af aminosyrer. Disse netværk lover at være skabelon
Forståelse af enzymudvikling baner vejen for grøn kemiLaboratorieudvikling af et designerenzym gør det til en meget bedre katalysator. Simuleringer viser, at evolutionen gør dette ved at indføre netværk af aminosyrer. Disse netværk lover at være skabelon -
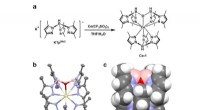 Dybblå organiske lysemitterende dioder baseret på et dublet-emission cerium(III) kompleksen. Syntetisk rute for komplekset. b. Enkeltkrystalstruktur af komplekset vist som ellipsoider ved 50 % sandsynlighedsniveau, hvor gul repræsenterer Ce, pink repræsenterer B, blå repræsenterer N, rød
Dybblå organiske lysemitterende dioder baseret på et dublet-emission cerium(III) kompleksen. Syntetisk rute for komplekset. b. Enkeltkrystalstruktur af komplekset vist som ellipsoider ved 50 % sandsynlighedsniveau, hvor gul repræsenterer Ce, pink repræsenterer B, blå repræsenterer N, rød -
 Solar dampgeneratorer kunne laves med træ, stof eller svampeI en ny undersøgelse, UChicago og Argonne -forskere hjælper med at være banebrydende i en ny metode til generering af soldampe. Kredit:Advanced Materials Interfaces Når den globale befolkning voks
Solar dampgeneratorer kunne laves med træ, stof eller svampeI en ny undersøgelse, UChicago og Argonne -forskere hjælper med at være banebrydende i en ny metode til generering af soldampe. Kredit:Advanced Materials Interfaces Når den globale befolkning voks
- Forklarer:hvad er undersøgelsesbaseret læring, og hvordan hjælper det med at forberede børn til …
- Eksplosiv atombevægelse er et nyt vindue til voksende metal nanostrukturer
- To for én i solenergi
- Hvilken slags kemisk binding er chloroform?
- NeuNetS:Automatisering af neurale netværksmodelsyntese til bredere anvendelse af AI
- Sådan fungerer en supernova


