Hvilken type obligationer dannes kulstof?
* Elektronkonfiguration: Carbon har fire valenselektroner (elektroner i sin yderste skal). For at opnå en stabil oktetkonfiguration (otte elektroner i dens yderste skal), skal den dele fire elektroner.
* Stærke obligationer: Kovalente bindinger involverer deling af elektroner mellem atomer, hvilket resulterer i stærke og stabile bindinger.
Typer af kovalente obligationer Kulstofformer:
* enkelt kovalente obligationer: Carbon kan dele et elektron med et andet atom, der danner en enkelt kovalent binding. For eksempel danner carbon i methan (CH4) fire enkeltbindinger med fire hydrogenatomer.
* dobbelt kovalente obligationer: Carbon kan dele to elektroner med et andet atom og danne en dobbelt kovalent binding. For eksempel danner carbon i kuldioxid (CO2) to dobbeltbindinger med to iltatomer.
* Triple kovalente obligationer: Carbon kan dele tre elektroner med et andet atom og danne en tredobbelt kovalent binding. For eksempel danner to carbonatomer i acetylen (C2H2) en tredobbelt binding mellem dem.
Hvorfor ikke ioniske bindinger?
Carbon har en relativt høj elektronegativitet (dens evne til at tiltrække elektroner). Selvom det kan danne nogle polære kovalente bindinger, danner det sjældent ioniske bindinger. Ioniske bindinger forekommer typisk mellem elementer med signifikant forskellig elektronegativitet, hvor det ene atom mister elektroner for at blive positivt ladet (kation) og de andre får elektroner til at blive negativt ladet (anion).
Nøglepunkter:
* Carbons evne til at danne fire kovalente bindinger giver det mulighed for at danne en lang række molekyler med forskellige former og egenskaber.
* Styrken og alsidigheden af Carbon's kovalente bindinger er vigtige for mangfoldigheden og kompleksiteten i livet på jorden.
 Varme artikler
Varme artikler
-
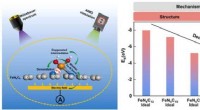 Forskere afslører nedbrydningsmekanismen for ikke-ædelmetalkatalysatorer til brændselscellerGrafisk abstrakt. Kredit:Anvendt katalyse B:Miljø (2022). DOI:10.1016/j.apcatb.2022.121290 Udviklingen af effektive ikke-ædelmetalkatalysatorer (NPMCer) kan hjælpe med at reducere omkostningerne
Forskere afslører nedbrydningsmekanismen for ikke-ædelmetalkatalysatorer til brændselscellerGrafisk abstrakt. Kredit:Anvendt katalyse B:Miljø (2022). DOI:10.1016/j.apcatb.2022.121290 Udviklingen af effektive ikke-ædelmetalkatalysatorer (NPMCer) kan hjælpe med at reducere omkostningerne -
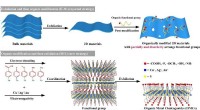 2-D-bestilte organiske metalchalcogenider udviklet med vidt indstillelige elektroniske båndgabSkematisk illustration af forskningen. Kredit:Prof. XUs gruppe To-dimensionelle (2-D) materialer, som viser fremragende fysiske og kemiske egenskaber, har modtaget hidtil uset opmærksomhed og er b
2-D-bestilte organiske metalchalcogenider udviklet med vidt indstillelige elektroniske båndgabSkematisk illustration af forskningen. Kredit:Prof. XUs gruppe To-dimensionelle (2-D) materialer, som viser fremragende fysiske og kemiske egenskaber, har modtaget hidtil uset opmærksomhed og er b -
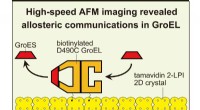 Et chaperonin protein, GroEL, har en mere kompleks mekanisme, end man troede førHS-AFM-billeddannelse afslørede allosterisk interring-kommunikation i GroEL, der styrer dens chaperoninreaktion. For at visualisere dynamiske GroEL-GroES-interaktioner med højhastigheds AFM, GroEL bio
Et chaperonin protein, GroEL, har en mere kompleks mekanisme, end man troede førHS-AFM-billeddannelse afslørede allosterisk interring-kommunikation i GroEL, der styrer dens chaperoninreaktion. For at visualisere dynamiske GroEL-GroES-interaktioner med højhastigheds AFM, GroEL bio -
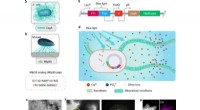 Lysfølsomme E. coli-funktionelle biofilm som stilladser til hydroxyapatitmineraliseringEngineering light-responsive E. coli funktionelle biofilm som stilladser til HA-mineralisering. Engineering light-responsive E. coli funktionelle biofilm som stilladser til HA-mineralisering. (a) Skem
Lysfølsomme E. coli-funktionelle biofilm som stilladser til hydroxyapatitmineraliseringEngineering light-responsive E. coli funktionelle biofilm som stilladser til HA-mineralisering. Engineering light-responsive E. coli funktionelle biofilm som stilladser til HA-mineralisering. (a) Skem
- Hvad er Ammonias Chemical Name?
- Airbus, Boeing flyver ind på lukrative servicemarkeder
- Hvad er nogle planter og dyr, der er indfødte specifikt til Nordamerika Central Sydamerika?
- Hvad fanger Jordens atmosfære fra solen?
- Ny administrerende direktør står ved 737 MAX, blik nulstillet på urolige Boeing
- Brasiliens skovkodeks kan balancere landbrugets og miljøets behov


