Hvorfor bryder vandmolekyler andre polære molekyler op?
1. Polaritet:
* Vandmolekyler har en bøjet form, hvor ilt er mere elektronegativ end brint. Dette skaber en delvis negativ ladning på iltatomet og delvis positive ladninger på hydrogenatomerne.
* Polære molekyler har også ujævn ladningsfordeling, hvor den ene ende har en delvis positiv ladning og den anden ende en delvis negativ ladning.
2. Hydrogenbindinger:
* De delvis positive hydrogenatomer i et vandmolekyle tiltrækkes af det delvis negative iltatom i et andet vandmolekyle, der danner brintbindinger.
* Disse stærke bindinger skaber et sammenhængende netværk af vandmolekyler.
3. Opbrydelse af polære molekyler:
* Når et polært molekyle kommer ind i vandet, omgiver vandmolekylerne det og danner brintbindinger med de polære ender af molekylet.
* Den stærke attraktion af vandmolekyler til det polære molekyle forstyrrer interaktionerne mellem det polære molekyls egne komponenter og trækker det i det væsentlige fra hinanden.
* Denne proces kaldes solvation eller hydrering .
Eksempel:
* Tabel salt (NaCl) er et polært molekyle. Når vandmolekylerne opløses i vand, omgiver vandmolekylerne natrium- og chloridioner.
* De delvise negative iltatomer af vand tiltrækkes af de positivt ladede natriumioner, og de delvise positive hydrogenatomer af vand tiltrækkes af de negativt ladede chloridioner.
* Dette forstyrrer de ioniske bindinger, der holder natrium- og chloridioner sammen, så de kan adskille sig og opløses i vand.
Kortfattet: Vands stærke polaritet og evne til at danne brintbindinger giver det mulighed for effektivt at nedbryde andre polære molekyler ved at tiltrække dem og forstyrre deres interne interaktioner. Dette er grunden til, at vand ofte kaldes det "universelle opløsningsmiddel" for polære stoffer.
 Varme artikler
Varme artikler
-
 Meget stabil vandelektrolysekatalysator til produktion af brint og oxygenSkematisk diagram over foreslåede gebyroverførselsprocesser mellem MoSe 2 og LSC. Kredit:UNIST En nylig undersøgelse, tilknyttet UNIST har præsenteret ædle katalysatorer til vandelektrolyse, i s
Meget stabil vandelektrolysekatalysator til produktion af brint og oxygenSkematisk diagram over foreslåede gebyroverførselsprocesser mellem MoSe 2 og LSC. Kredit:UNIST En nylig undersøgelse, tilknyttet UNIST har præsenteret ædle katalysatorer til vandelektrolyse, i s -
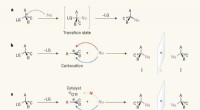 Brug af en SN1-reaktion til at lave kvartære stereocentreSpejlbillede-selektivitet i substitutionsreaktioner. en, I en SN2-reaktion, en reaktant kaldet en nukleofil (Nu; prikker angiver et ensomt elektronpar) angriber et kulstofatom i et organisk molekyle f
Brug af en SN1-reaktion til at lave kvartære stereocentreSpejlbillede-selektivitet i substitutionsreaktioner. en, I en SN2-reaktion, en reaktant kaldet en nukleofil (Nu; prikker angiver et ensomt elektronpar) angriber et kulstofatom i et organisk molekyle f -
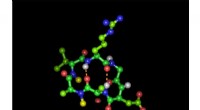 Den hellige gral af peptidkemi:Gør peptidaktive midler tilgængelige oraltCyklisk hexapeptid i sin bioaktive form med den integrinbindende tripeptidsekvens arginin-glycin-asparaginsyre:Grønne kugler repræsenterer carbonatomer, røde iltatomer, blå nitrogenatomer og hvide bri
Den hellige gral af peptidkemi:Gør peptidaktive midler tilgængelige oraltCyklisk hexapeptid i sin bioaktive form med den integrinbindende tripeptidsekvens arginin-glycin-asparaginsyre:Grønne kugler repræsenterer carbonatomer, røde iltatomer, blå nitrogenatomer og hvide bri -
 Selvmonteret induceret luminescens af Eu3+-komplekser til anvendelse på bioimagingKredit:CC0 Public Domain De unikke egenskaber ved sjældne jordarter (RE) -komplekser, herunder ligand-sensibiliseret energioverførsel, fingeraftrykslignende emissioner og lang levetid gøre dem lov
Selvmonteret induceret luminescens af Eu3+-komplekser til anvendelse på bioimagingKredit:CC0 Public Domain De unikke egenskaber ved sjældne jordarter (RE) -komplekser, herunder ligand-sensibiliseret energioverførsel, fingeraftrykslignende emissioner og lang levetid gøre dem lov
- Ændring af identiteten af cellulært enzym afføder ny vej
- Udbredt brug af PFAS i kosmetik, ny undersøgelse finder
- Er en pen fast væske eller gas?
- Hvad er tre hovedtyper af arbejde, som celler udfører og giver eksempler hver?
- Hvordan jerncarbener lagrer energi fra sollys - og hvorfor de ikke er bedre til det
- Vil du have en bedre pendling? Deltag i Dash Beta Test


