Ændring af identiteten af cellulært enzym afføder ny vej
Integrerede membranproteiner, eller IMP'er, er en vigtig klasse af proteiner, der spiller afgørende roller i mange cellulære processer, herunder katalyse af disulfidbindinger, som er afgørende for funktionen og stabiliteten af mange proteiner såsom antistoffer, som har et betydeligt terapeutisk potentiale.
Men IMP'er er i sig selv hydrofobe og har derfor lav opløselighed i vandige miljøer. Deres naturlige miljø er inden for lipid -dobbeltlagsmembranen i en celle, hvilket gør det svært at studere deres struktur og funktion.
En tidligere rapporteret metode, der involverer standard rekombinante DNA -teknikker og nogle nye designprincipper, gjorde det muligt for et team af Cornell -kemiingeniører at lave store mængder funktionelle IMP'er enkelt og billigt - alt sammen uden brug af hårde kemikalier eller vaskemidler, som typisk bruges i dag. Det hold, ledet af Matt DeLisa, William L. Lewis professor i teknik ved Robert Frederick Smith School of Chemical and Biomolecular Engineering, har nu brugt den proteintekniske metode til at omdanne et membranbundet enzym til en vandopløselig biokatalysator, der fungerer direkte i den vandige indre celle.
"Du kan redesigne disse vanskelige proteiner, gør dem vandopløselige, og måske virkelig overraskende, de kan fortsætte med at katalysere deres naturlige biologiske reaktioner, "sagde DeLisa, hovedundersøger for "En vandopløselig DsbB-variant, der katalyserer dannelse af disulfidbinding in vivo, "udgivet 19. juni i Naturens kemiske biologi .
"Så vidt vi ved, dette er det første eksempel på at skabe en vandopløselig IMP, der bevarer sin naturlige katalytiske aktivitet, men gør det i et helt nyt cellulært miljø, "Sagde DeLisa." Og fordi det er en genetisk konstrueret konstruktion, det kan udtrykkes som ethvert andet opløseligt protein med meget lille indsats eller besvær. "
Første forfatter er Dario Mizrachi, tidligere postdoktor i kemi og biomolekylær teknik, der nu er adjunkt ved Brigham Young University. Blandt samarbejdspartnere var Michael-Paul Robinson, doktorand i kemisk og biomolekylær teknik, og Mehmet Berkmen fra New England Biolabs.
Gruppens tidligere arbejde detaljerede en metode, de kaldte SIMPLEx (Solubilization of Integral Membrane Proteins with High Levels of Expression), til beskyttelse af IMP'er fra vand og muliggør produktion af store mængder af disse vanskeligt fremstillede proteiner. Ved hjælp af rekombinante DNA -teknikker, de syede et kunstigt membranprotein sammen med en identitetskrise - et, der bevarer sin biologiske funktion, men synes det er opløseligt i vand.
Dette seneste værk er den første anvendelse af denne teknik. Gruppen brugte deres identitetsskiftede IMP'er til at lave disulfidbindinger, en type post-translationel ændring, der forekommer i mange proteiner og påvirker næsten alle aspekter af normal cellebiologi og patogenese.
Gruppen målrettede det bakterielle integrale membranenzym DsbB, en central biokatalysator i disulfidbindingsdannelse, selvom DeLisa mener, at teknikken kan overføres til utallige andre membranproteiner.
Ved hjælp af SIMPLEx -metoden, gruppen omdannede membranbundet DsbB til en vandopløselig biokatalysator, der let kunne udtrykkes i E. coli-cytoplasma, hvor det affødte disulfid-bindingsdannelse i en række proteinmål.
Disulfidbindinger er nøglespillere i mange terapeutiske proteiner, såsom monoklonale antistoffer. Mange kræftlægemidler anvender disse molekyler, som kan efterligne eller forstærke immunsystemets angreb på tumorceller.
Evnen til at tage katalysatoren ud af lipidmembranen og putte den i cytoplasmaet, DeLisa sagde, tillader forskere at lave disse antistoffer på potentielt mere gunstige steder i cellen.
"Vi kunne lave denne vej i cytoplasmaet ... [eller] vi kunne flytte alt til et andet subcellulært rum som periplasma, eller potentielt tage hele vejen ud af cellen og rekonstituere den i et cellefrit system, "Sagde DeLisa." Pointen er, Vi skaber en enorm fleksibilitet med hensyn til at lave disse bindinger ved i det væsentlige at gøre et membranprotein til et opløseligt enzym. "
 Varme artikler
Varme artikler
-
 Nyudviklet molekyle til forbedring af lægemidler henter inspiration fra naturens værktøjskasseKredit:Colorado State University I kapløbet om at skabe mere potente og stabile lægemidler, videnskabsmænd ved, at tilsætning af fluor kan forbedre lægemiddelmolekyler. Imidlertid, der er kun én
Nyudviklet molekyle til forbedring af lægemidler henter inspiration fra naturens værktøjskasseKredit:Colorado State University I kapløbet om at skabe mere potente og stabile lægemidler, videnskabsmænd ved, at tilsætning af fluor kan forbedre lægemiddelmolekyler. Imidlertid, der er kun én -
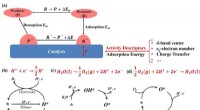 Aktivitetsbeskrivelser for elektrokatalysatorer i energilagringsapplikationer(a) Forskellige aktivitetsdeskriptorer for elektrokemiske reaktioner og katalytiske cyklusser af (b) hydrogenudviklingsreaktion, (c) oxygenudviklingsreaktion og (d) oxygenreduktionsreaktion i brændsel
Aktivitetsbeskrivelser for elektrokatalysatorer i energilagringsapplikationer(a) Forskellige aktivitetsdeskriptorer for elektrokemiske reaktioner og katalytiske cyklusser af (b) hydrogenudviklingsreaktion, (c) oxygenudviklingsreaktion og (d) oxygenreduktionsreaktion i brændsel -
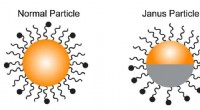 Kemikere skaber en kemisk sonde for bedre at forstå immunresponsOpkaldt efter den to-ansigtede romerske gud, en Janus partikel, ret, er belagt med to separate molekyletyper på tværs af overfladen. Kredit:Lucy Sanchez En trio af kemikere ved Indiana University
Kemikere skaber en kemisk sonde for bedre at forstå immunresponsOpkaldt efter den to-ansigtede romerske gud, en Janus partikel, ret, er belagt med to separate molekyletyper på tværs af overfladen. Kredit:Lucy Sanchez En trio af kemikere ved Indiana University -
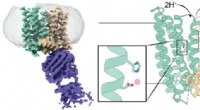 Afslører den uventede struktur af jern-eksportør ferroportin3D -struktur af et ferroportin fra pattedyr. Det venstre panel viser et kryo-EM-tæthedskort over ferroportin (blågrønt og brunt) i kompleks med et antistof (lilla). Midter- og højre panel viser en teg
Afslører den uventede struktur af jern-eksportør ferroportin3D -struktur af et ferroportin fra pattedyr. Det venstre panel viser et kryo-EM-tæthedskort over ferroportin (blågrønt og brunt) i kompleks med et antistof (lilla). Midter- og højre panel viser en teg
- Global opvarmning tegner sig for tredobling af ekstreme vestafrikanske Sahel-storme, viser undersøg…
- Forskere advarer om, at moderne slaveri er blevet forværret af COVID-19
- Sådan beregnes en rabat på 10 procent
- Ny rekord:3-D-printet optisk-elektronisk integration
- Streetcars garanterer ikke øget udviklingsaktivitet, undersøgelse finder
- FN-rapport om mission umulig klimamål:nøglepunkter


