Forståelse af enzymet, der gør det muligt for bakterier at indånde arsen
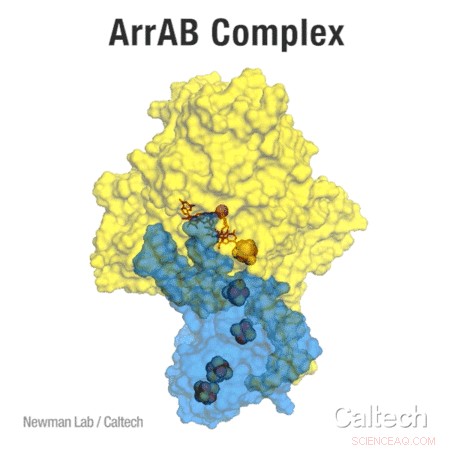
ArrAB-komplekset-enzymet, der muliggør respiration af arsenat-løst ved røntgenkrystallografi. Enzymet består af to dele:ArrA vist med gult, og ArrB i blåt. En bue af jern-svovlklynger overfører elektroner - et nødvendigt trin i respirationsprocessen - til et arsenatom ved hjælp af et molybdænatom. Kredit:Udlånt af Newman-laboratoriet
Arsen-forurenet drikkevand er en stor sundhedsfare, med kronisk eksponering, der forårsager sygdomme og kræft. Verdenssundhedsorganisationen vurderer, at i Bangladesh, for eksempel, over 5 millioner mennesker blev udsat for arsen-forurenet drikkevand i 2009. Ofte, arsen frigives til vand af mikrober, der ånder, eller hvile, arsenholdige forbindelser. Caltech-forskere har nu fastslået strukturen af det bakterielle enzym, der muliggør arsen-respiration. Arbejdet er et vigtigt skridt i retning af at forudsige biologiske påvirkninger af arsenmobilisering i miljøet.
Arbejdet blev udført i Dianne Newmans laboratorium, Gordon M. Binder/Amgen professor i biologi og geobiologi, Allen V. C. Davis og Lenabelle Davis lederskabsformand for Caltechs Center for Environmental Microbial Interactions, og administrerende direktør for molekylærbiologi.Det fremgår af et papir i 13. august -udgaven af Proceedings of the National Academy of Sciences .
Blandt de giftige arsenholdige forbindelser, der forurener drikkevandet, er arsenater. Disse forbindelser findes almindeligvis forbundet med jernmineraler i sedimentære miljøer. I denne form, arsenater vil sandsynligvis ikke opløses i grundvandet, der strømmer gennem disse geologiske aflejringer. Når bakterier i disse miljøer løber tør for ilt, de kan gå ind i en anaerob tilstand og vende sig til respinerende arsenat. Derved, mikroberne ændrer arsenat til arsenit, en lignende forbindelse, som er meget mere opløselig i vand. Mange forskellige typer bakterier har denne evne, nøglen til hvilket er et bestemt protein kaldet Arr enzymkomplekset.
Et internationalt forskerteam ledet af den tidligere Caltech -kandidatstuderende Nathaniel Glasser (Ph.D. '17) har nu bestemt enzymets fysiske struktur og de præcise molekylære steder, hvor det kemisk interagerer med arsenat.
Proteiner som Arr-komplekset er så små, at de ikke kan ses med et optisk mikroskop. Dermed, Caltech-teamet vendte sig til en teknik kaldet røntgendiffraktion for at afsløre enzymets struktur. At opdage præcis hvordan dette enzym er opbygget er vigtigt for at forstå dets specifikke funktioner, især fordi der findes lignende proteiner, der interagerer med arsenforbindelser på forskellige måder. Derudover Glasser var i stand til at undersøge enzymet som produceret af Shewanella-bakterier - mikrober, der faktisk udfører arsenat-respiration i miljøet - i stedet for i den organisme, der almindeligvis anvendes i laboratoriet til bakteriel proteinekspression, Escherichia coli (E. coli). Selvom E. colican udfører arsenatrespiration og udtrykker Arr-enzymkomplekset, Shewanellacan producerer meget mere aktivt protein.
Grunden til at arsenat er giftigt for mennesker, er fordi det kemisk ligner fosfat, en nødvendig forbindelse for celler til at lave ATP, cellens energivaluta. Hvis der er for meget arsenat til stede, cellen begynder at optage det i stedet for fosfat, ødelægge cellens evne til at lave ATP. I dette studie, Glasser og hans kolleger målte Arr-enzymets aktivitet i nærværelse af forskellige niveauer af fosfat.
"I modsætning til hvad man kan forvente, fosfat stimulerer sandsynligvis respiration af arsenat frem for at hæmme det i typiske sedimentære miljøer i kontakt med grundvand. At vide, hvor hurtigt dette enzym virker under miljørelevante forhold, bringer os et skridt tættere på at være i stand til at forudsige, hvor meget bakterier der kan mobilisere arsen til drikkevand i visse lokaliteter, " siger Newman. "Denne forskning vil ikke løse krisen i Bangladesh, men at have et bedre kvantitativt greb om, hvad der sker, er nyttigt til at løse stort set ethvert problem, og især vigtigt, når man skal tackle et komplekst miljøproblem, hvor mange faktorer er involveret. Dette arbejde giver nyttig information om et enzym, der, så vidt vi ved, findes i enhver bakterie, der respirerer arsenat."
Artiklen har titlen "Strukturel og mekanistisk analyse af arsenat respiratorisk reduktase giver indsigt i miljømæssige arsen transformationer."
 Varme artikler
Varme artikler
-
 Carboncykling i våd jordAutomatiseret svingende vandbord jordsøjle eksperimentel opsætning, hvor de vandtætte forhold pålægges ved hjælp af en computerstyret, flerkanalspumpe forbundet til et hydrostatisk ligevægtsreservoir
Carboncykling i våd jordAutomatiseret svingende vandbord jordsøjle eksperimentel opsætning, hvor de vandtætte forhold pålægges ved hjælp af en computerstyret, flerkanalspumpe forbundet til et hydrostatisk ligevægtsreservoir -
 Lava, askestrømme, mudderskred og grimme gasser - gode grunde til at respektere vulkanerLavastrømmen bevæger sig i Leilani Estates underafdelingen nær Pahoa på øen Hawaii, 6. maj, 2018. Kredit:USGS via AP, CC BY Vulkaner er smukke og ærefrygtindgydende, men det igangværende udbrud af
Lava, askestrømme, mudderskred og grimme gasser - gode grunde til at respektere vulkanerLavastrømmen bevæger sig i Leilani Estates underafdelingen nær Pahoa på øen Hawaii, 6. maj, 2018. Kredit:USGS via AP, CC BY Vulkaner er smukke og ærefrygtindgydende, men det igangværende udbrud af -
 Har online shopping ændret hvor meget pap vi bruger?Har stigningen i e-handel haft indflydelse på papindustrien? Arterra/UIG/Getty Images Fra dagligvarer til gadgets, hjemmeleveringen af varer deponerer papkasser på dørtrin i hele Amerika, og vi er
Har online shopping ændret hvor meget pap vi bruger?Har stigningen i e-handel haft indflydelse på papindustrien? Arterra/UIG/Getty Images Fra dagligvarer til gadgets, hjemmeleveringen af varer deponerer papkasser på dørtrin i hele Amerika, og vi er -
 Forskere:Ingen måde at vide, hvornår Hawaii-udbruddet slutterDenne onsdag, 6. juni, Foto fra 2018 fra U.S. Geological Survey viser et fiskeøjebillede af et lavadelta, der fylder den tidligere Kapoho-bugt ved byen Kapoho på øen Hawaii. Mens deltamarginen nærmest
Forskere:Ingen måde at vide, hvornår Hawaii-udbruddet slutterDenne onsdag, 6. juni, Foto fra 2018 fra U.S. Geological Survey viser et fiskeøjebillede af et lavadelta, der fylder den tidligere Kapoho-bugt ved byen Kapoho på øen Hawaii. Mens deltamarginen nærmest
- Er du sikker på lyn, hvis stormen endnu ikke har ramt?
- Hvad du behøver at vide om SpaceXs Demo-2-mission
- Forskere afkoder dynamikken i den største proteinnedbrydende maskine i atomare detaljer
- Sort fosfor tunnel felteffekt transistor som en ultra-lav effekt switch
- NASA, Den Europæiske Rumorganisation går sammen om klimaændringer
- Kontrol af strømme af flydende metal ved stuetemperatur


