IU-kirurgers nanopartikelforskning tager inspiration fra græsk mytologi
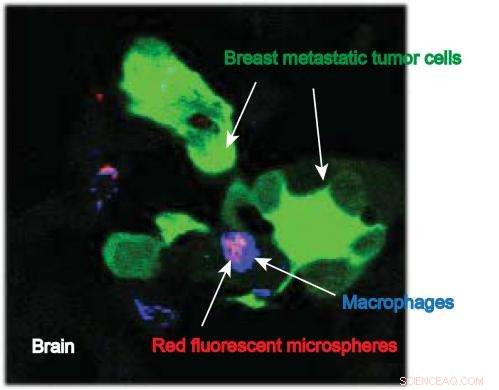
Dette billede fra IU School of Medicine-forsker Susan Clare viser makrofager, der bærer nanopartikler (med et fluorescerende farvestof påsat) på stedet for metastaserende brysttumorceller i hjernen. Kredit:Susan Clare, M.D., Ph.D.
En brystkræftkirurg ved Indiana University School of Medicine forfølger forskning, der vil bruge glas, guld, nanoteknologi og græsk mytologi i håb om at overvinde brystkræft, der har metastaseret til hjernen.
Susan E. Clare, M.D., Ph.D., lektor i kirurgi ved IU School of Medicine, er den initierende hovedefterforsker for en $573, 000 Department of Defense-bevilling, der vil give hende mulighed for at udforske en ny tilgang til at levere terapi til hjernemetastaser fra primær brystkræft.
Ligesom grækerne i gamle dage, Dr. Clare håber på skjult at levere "krigere" til fjendens højborg, i dette tilfælde en metastatisk hjernetumor. Hendes forskning vil udforske at bruge en celle fra kroppens immunsystem til at levere kemoterapi direkte til hjernemetastaserne. Lægemidlet eller andet terapeutisk middel er knyttet til nanosfærerne, som bæres i immuncellen, ligesom soldater blev båret inden for den trojanske hest. Immuncellerne rejser i blodbanen og frigiver stoffet, når det har nået tumorstedet.
De to former for brystkræft, der oftest metastaserer til hjernen, er HER2 positive og tredobbelte negative. Der er ingen specifikt målrettet behandling tilgængelig til behandling af triple negative metastatiske tumorer, men lapatinib er en standardbehandling for HER2-positiv kræft, der har spredt sig til andre dele af kroppen.
"Problemet for næsten alle stoffer, og HER2-målrettede lægemidler er ingen undtagelse, er, at blod-hjerne-barrieren er en væsentlig hindring for at levere behandlinger i koncentrationer, der kan være effektive, " sagde Dr. Clare. Det biologiske problem fik Dr. Clare til at udforske andre metoder til at levere medicin til metastaserende hjernetumorer.
Ved at bruge nanopartikler kaldet "nanoskaller, " udviklet af Naomi J. Halas, Ph.D., D.Sc., direktør for Laboratoriet for Nanofotonik ved Rice University, Dr. Clare håber at målrette hjernetumorerne med lapatinib i en dosis, der er tilstrækkelig til at lukke ned for den signalvej, der er nødvendig for, at kræftcellerne kan formere sig.
I en juli-artikel i tidsskriftet Kræft nanoteknologi , Drs. Clare og Halas og kolleger viste, at immuncellerne, der bærer nanopartiklerne, var i stand til at krydse blod-hjerne-barrieren og hjem til hjernemetastaser i en eksperimentel musemodel.
Først, en komponent af hvide blodlegemer kaldet makrofager - alsidige celler, der initierer et immunrespons efter infiltrering af unormale (kræftceller) - opsamles. Nanopartiklerne indtages af makrofagerne, som derefter frigives til blodbanen. Dr. Clare sagde, at makrofagerne tiltrækkes af metastaserne af kemoattraktanter, som er kemikalier produceret af tumoren.
Disse nanopartikler er i fase I kliniske studier til behandling af hoved- og halskræft, avanceret prostatacancer og lungekræft gennem Nanospectra Biosciences, baseret i Houston, Texas. Fordi blod-hjerne-barrieren blev anset for at være en væsentlig hindring for levering, deres behandlingseffektivitet for hjernemetastaser var ikke inkluderet i den indledende test. Dr. Clares forsvarsministeriums bevilling vil tillade forskning inden for tre nøgleområder.
Det første mål er at vise, at kemoterapimidlerne kan bindes til nanopartiklerne og frigives efter behag på det passende sted i hjernen, sagde Dr. Clare. Frigivelse "efter behag" er afgørende i processen.
"Medikamentet frigives fra partiklen ved at skinne en laser på partiklen, " sagde hun. "Medikamentet transporteres mellem to stykker DNA, der er negativt ladet. Når de udsættes for laserlyset, elektronerne skifter fra nanopartikler til DNA, lader det frigive stoffet."
Makrofagerne fører nanopartiklerne direkte til kræftcellerne, så når stoffet frigives, det er præcis, hvor det skal være for at diffundere til tumoren og afbryde de metastatiske cellers cellulære aktivitet.
Hvor simpelt det end lyder, det er ikke.
Nanopartiklerne er en silicakugle dækket med guld, som har vist sig at være ugiftigt i omfattende, langsigtede videnskabelige undersøgelser. Tykkelsen af skallen af guld bestemmer, hvor på lysspektret laserlyset absorberes. For maksimal vævsgennemtrængning, nanopartiklerne skal absorbere lys i det nære infrarøde. Nanopartiklerne udviklet af Dr. Halas gør netop det.
Imidlertid, kraniets knogle udgør en yderligere udfordring for at levere tilstrækkelig laserkraft til nanopartiklerne. At øge laserens kraft er ikke svaret, fordi det vil brænde huden. Der er mange variable i gåden, men Dr. Clare har forlovet Keith Stantz, Ph.D., adjungeret adjunkt i radiologi ved Indiana Institute of Biomedical Imaging Sciences, og Jacqueline A. Johnson, Ph.D., lektor ved University of Tennessee Space Institute, som begge er eksperter i nanosekund- og femtosekundlasere. Holdet mener, at de har en løsning på magtudfordringen og vil teste den i musemodeller.
"Det er en stor brik i puslespillet, " Dr. Clare sagde. "Guld bruges som skal for partiklen på grund af dets fysiske egenskaber. Præcise beregninger for tykkelsen af guldet, den ideelle penetrationsdybde og laserens kraft var udfordringer, der skulle løses, før effektiviteten af leveringssystemet for lægemidlet kan studeres."
 Varme artikler
Varme artikler
-
 Forskere bruger multivalente guld nanopartikler til at udvikle effektiv molekylær sondeGrafisk abstrakt, som den guld-nanopartikel-baserede affinitetsmærkning til identifikation af specifikke kulhydratbindende proteiner. Kredit:Kaori Sakurai/ TUAT Celler spiller et præcist spil tele
Forskere bruger multivalente guld nanopartikler til at udvikle effektiv molekylær sondeGrafisk abstrakt, som den guld-nanopartikel-baserede affinitetsmærkning til identifikation af specifikke kulhydratbindende proteiner. Kredit:Kaori Sakurai/ TUAT Celler spiller et præcist spil tele -
 Små plastikpartikler i miljøetNanoplast:partikler i nanometerområdet (elektronmikroskopibillede, farvet, 50, 000x). Kredit:Empa / ETH Hvor end forskerne kigger hen, de kan få øje på dem:hvad enten det er i fjerntliggende bjerg
Små plastikpartikler i miljøetNanoplast:partikler i nanometerområdet (elektronmikroskopibillede, farvet, 50, 000x). Kredit:Empa / ETH Hvor end forskerne kigger hen, de kan få øje på dem:hvad enten det er i fjerntliggende bjerg -
 Graphene muliggør urfrekvenser i terahertz -områdetGraphene konverterer elektroniske signaler med frekvenser i gigahertz -området ekstremt effektivt til signaler med flere gange højere frekvens. Kredit:Juniks/HZDR Grafen - et ultratyndt materiale
Graphene muliggør urfrekvenser i terahertz -områdetGraphene konverterer elektroniske signaler med frekvenser i gigahertz -området ekstremt effektivt til signaler med flere gange højere frekvens. Kredit:Juniks/HZDR Grafen - et ultratyndt materiale -
 Carbon nanorør sænker transformationstemperaturen af glasagtig kulstofPrøver af kulstofnanorør og polymere phenol-formaldehydmaterialer hærdet ved bagning ved høj temperatur i fravær af oxygen:(a) en kulstofnanorørskov; (b) et carbonnanorør/polymer nanokomposit; (c) et
Carbon nanorør sænker transformationstemperaturen af glasagtig kulstofPrøver af kulstofnanorør og polymere phenol-formaldehydmaterialer hærdet ved bagning ved høj temperatur i fravær af oxygen:(a) en kulstofnanorørskov; (b) et carbonnanorør/polymer nanokomposit; (c) et
- Open source-software låser op for 3D-visning af nanomaterialer
- Mediers indramning af sygdom kan føre til AAPI-diskrimination
- Ferier bringer en stigning i phishing-svindel rettet mod små virksomheder
- Nedgravning af kulstof har potentiale til at forbedre kulstofbindingen uden at reducere græsprodukt…
- Den vesteuropæiske trykanomali kan føre til forbedrede prognoser for ekstreme bølgeforhold
- Sort silicium kan hjælpe med at opdage sprængstoffer


