Ny teknik retter sig mod specifikke områder af kræftceller med forskellige lægemidler

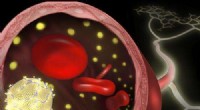
Billedet viser strukturen af nanopartiklerne (venstre), og hvordan nanopartiklerne kommer ind på en tumor og krymper den (til højre).
(Phys.org) – Forskere har udviklet en teknik til at skabe nanopartikler, der bærer to forskellige kræftdræbende lægemidler ind i kroppen og leverer disse lægemidler til adskilte dele af kræftcellen, hvor de vil være mest effektive. Teknikken er udviklet af forskere ved North Carolina State University og University of North Carolina ved Chapel Hill.
"Ved test på laboratoriemus, vores teknik resulterede i betydelig forbedring af brystkræfttumorreduktion sammenlignet med konventionelle behandlingsteknikker, " siger Dr. Zhen Gu, seniorforfatter til et papir om forskningen og en adjunkt i det fælles biomedicinske ingeniørprogram ved NC State og UNC-Chapel Hill.
"Kræftceller kan udvikle resistens over for kemoterapimedicin, men er mindre tilbøjelige til at udvikle resistens, når flere lægemidler administreres samtidigt, " siger Gu. "Men forskellige lægemidler retter sig mod forskellige dele af kræftcellen. For eksempel, proteinlægemidlet TRAIL er mest effektivt mod cellemembranen, mens doxorubicin (Dox) er mest effektivt, når det leveres til kernen. Vi har fundet frem til en sekventiel og stedspecifik leveringsteknik, der først leverer TRAIL til cancercellemembraner og derefter trænger ind i membranen for at levere Dox til kernen."
Gus forskerhold udviklede nanopartikler med en ydre skal lavet af hyaluronsyre (HA) vævet sammen med TRAIL. HA interagerer med receptorer på kræftcellemembraner, som "griber" nanopartiklerne. Enzymer i kræftcellemiljøet nedbryder HA, frigiver TRAIL på cellemembranen og udløser i sidste ende celledød.
Når HA-skallen går i stykker, det afslører også kernen af nanopartikler, som er lavet af Dox, der er indlejret med peptider, der tillader kernen at trænge ind i kræftcellen. Kræftcellen omslutter kernen i en beskyttende boble kaldet et endosom, men peptiderne på kernen får endosomet til at begynde at bryde fra hinanden. Dette spilder Dox'en ind i cellen, hvor den kan trænge ind i kernen og udløse celledød.
"Vi designede dette lægemiddelleveringsmiddel ved at bruge en 'programmeret' strategi, " siger Tianyue Jiang, en hovedforfatter i Dr. Gus laboratorium. "Forskellige stoffer kan frigives på det rigtige tidspunkt på deres rigtige steder, " tilføjer Dr. Ran Mo, en postdoc-forsker i Gus laboratorium og den anden hovedforfatter.
"Denne forskning er vores første proof of concept, og vi vil fortsætte med at optimere teknikken for at gøre den endnu mere effektiv, " siger Gu. "De tidlige resultater er meget lovende, og vi mener, at dette kunne skaleres op til storskalaproduktion."
Papiret, "Gel-liposom-medieret co-levering af anticancer membran-associerede proteiner og små-molekyle lægemidler for forbedret terapeutisk effektivitet, " er offentliggjort online i Avancerede funktionelle materialer .
 Varme artikler
Varme artikler
-
 Brug af nanoteknologi til at forbedre effektiviteten i olieudvindingKredit:Worcester Polytechnic Institute Hvem sørger for, at verden opfylder sit energibehov, samtidig med at risici for planeten minimeres? Dit første gæt er måske ikke verdens største olieselskab.
Brug af nanoteknologi til at forbedre effektiviteten i olieudvindingKredit:Worcester Polytechnic Institute Hvem sørger for, at verden opfylder sit energibehov, samtidig med at risici for planeten minimeres? Dit første gæt er måske ikke verdens største olieselskab. -
 Gennemsigtigt ledende materiale kan føre til strømgenererende vinduerØverst:Scanning elektronmikroskopi billede og zoom af konjugeret polymer (PPV) honeycomb. Nederst (venstre mod højre):Konfokale fluorescensbilleder af konjugeret honeycomb, af polymer/fulleren -bikage
Gennemsigtigt ledende materiale kan føre til strømgenererende vinduerØverst:Scanning elektronmikroskopi billede og zoom af konjugeret polymer (PPV) honeycomb. Nederst (venstre mod højre):Konfokale fluorescensbilleder af konjugeret honeycomb, af polymer/fulleren -bikage -
 3D-udskrifter på nanoskala ved hjælp af selvsamlende DNA-strukturerBjörn Högberg og Erik Benson. Kredit:Ulf Sirborn En ny måde at lave 3D -nanostrukturer fra DNA er beskrevet i en undersøgelse offentliggjort i det anerkendte tidsskrift Natur . Undersøgelsen ble
3D-udskrifter på nanoskala ved hjælp af selvsamlende DNA-strukturerBjörn Högberg og Erik Benson. Kredit:Ulf Sirborn En ny måde at lave 3D -nanostrukturer fra DNA er beskrevet i en undersøgelse offentliggjort i det anerkendte tidsskrift Natur . Undersøgelsen ble -
 Forskere kombinerer svage kemiske kræfter for at styrke ny billeddannelsesteknologiKredit:Janet Sinn-Hanlon, DesignGroup@VetMed, University of Illinois (Phys.org) —Når University of Illinois lektor i kemi og biomolekylær teknik Hyunjoon Kong, kandidatstuderende Cartney Smith, og
Forskere kombinerer svage kemiske kræfter for at styrke ny billeddannelsesteknologiKredit:Janet Sinn-Hanlon, DesignGroup@VetMed, University of Illinois (Phys.org) —Når University of Illinois lektor i kemi og biomolekylær teknik Hyunjoon Kong, kandidatstuderende Cartney Smith, og
- Bakteriebyggere på stedet til computerbyggeri
- Gamle mønter kan løse mysteriet om en morderisk pirat fra 1600-tallet
- Ny metode til højhastighedssyntese af naturlige stemmer
- Ny undersøgelse tyder på nogle gamle bidmærker fra crocs ikke stenværktøjer
- Sådan identificeres en edderkop med webmønster
- Mange taxachauffører diskriminerer kørestolsbrugere


