Magnetiske nanopartikler bryder kapacitetsbarrieren for antistofoprensning
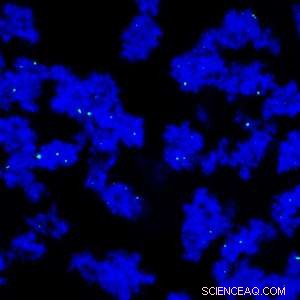
En ny separationsteknik bruger stivelsesovertrukne magnetiske nanopartikler (grønne) og polyethylenglycol til at rense monoklonale antistoffer (blå). Kredit:© 2013 Elsevier
Monoklonale antistoffer repræsenterer det største og hurtigst voksende segment af international biofarma. Selvom disse terapeutiske midler er en velsignelse for global sundhedspleje, Produktivitetsbegrænsninger udgør en alvorlig udfordring for producenter, der søger at lave tilstrækkelige mængder til terapeutiske anvendelser. Nu, A*STAR-forskere har udviklet en højkapacitetsmetode til at rense monoklonale antistoffer, der bruger magnetiske nanopartikler og introducerer også nye driftsbetingelser.
På nuværende tidspunkt terapeutiske antistoffer renses generelt ved en teknik kendt som protein A affinitetskromatografi. Processen giver en høj rensefaktor - typisk 99 procent - men den er langsom, derved skabe en alvorlig produktivitetsflaskehals. Processen er i høj grad hæmmet af den lave kapacitet af protein A, som binder monoklonale antistoffer med en gennemsnitlig hastighed på 50 gram pr. liter protein A kromatografimedie. Den overordnede oprensningsproces kræver, at urensede antistoffer passerer gennem kolonner pakket med mediet i flere cyklusser, der kan tage op til en uge.
Et forskerhold ledet af Pete Gagnon og kolleger fra A*STAR Bioprocessing Technology Institute i Singapore har udviklet en alternativ metode med 1, 000 gange kapaciteten af protein A. Teknikken involverer brug af polyethylenglycol, som forårsager, at antistofferne aflejres på overfladen af stivelsesovertrukne magnetiske nanopartikler (se billede). Partiklerne opsamles i et magnetfelt, ikke-aflejrede kontaminanter vaskes væk, og de rensede antistoffer genvindes ved at fjerne polyethylenglycolen.
"Den høje kapacitet af vores nanopartikelmetode gør den meget hurtigere end søjlekromatografi, " forklarer Gagnon. "I stedet for medicinalindustriens norm på fem til otte cyklusser, den nye proces kræver kun én cyklus, som tager blot et par timer." Denne reduktion øger dramatisk produktiviteten af den nye tilgang i forhold til traditionelle metoder.
Den nye metode krævede også, at forskerholdet udviklede nye driftsbetingelser. Polyethylenglycol er blevet brugt i årtier til at behandle antistoffer, men det har aldrig opnået det renhedsniveau, der er nødvendigt for klinisk behandling. Holdet opdagede, at ved at hæve saltkoncentrationen, de kunne reducere forureningsniveauet fra omkring 250, 000 ppm til 500:det samme niveau opnået af protein A. Et enkelt efterfølgende poleringstrin ved hjælp af en multimodal kromatografisøjle rensede antistofferne yderligere til kliniske kvalitetsstandarder.
Gagnon bemærker det store potentiale for vedtagelse af den nye teknologi i industrien. Ud over at løse det langvarige problem med produktivitet for monoklonale antistoffer, nanopartikeltilgangen kan anvendes på mange andre terapeutiske proteiner og også på virale vacciner.
 Varme artikler
Varme artikler
-
 Foldetragte nøgle til biomimikDenne AFM-mikrografik af 2-D S-lag samlet på glimmer viser to forskellige veje til krystallisering, den ene, hvor domanserne er 2-3 nanometer højere (hvide stiplede cirkler) end den anden. Forskelle i
Foldetragte nøgle til biomimikDenne AFM-mikrografik af 2-D S-lag samlet på glimmer viser to forskellige veje til krystallisering, den ene, hvor domanserne er 2-3 nanometer højere (hvide stiplede cirkler) end den anden. Forskelle i -
 Farvehologram bruger plasmoniske nanopartikler til at lagre store mængder informationForskellige typer nanopartikler, som spreder lys ved forskellige bølgelængder, bruges til at skabe et flerfarvet hologram. Kredit:Montelongo, et al. ©2014 PNAS (Phys.org) —I det 4 th århundrede,
Farvehologram bruger plasmoniske nanopartikler til at lagre store mængder informationForskellige typer nanopartikler, som spreder lys ved forskellige bølgelængder, bruges til at skabe et flerfarvet hologram. Kredit:Montelongo, et al. ©2014 PNAS (Phys.org) —I det 4 th århundrede, -
 Microneedles teknik kan betyde hurtigere diagnoser af større sygdommeSandia National Laboratories -forsker Philip Miller undersøger en mikronålenhed. Det nye enhedsdesign bruger en række nåle og kan ekstrahere 20 mikroliter interstitiel væske, sammenlignet med de to mi
Microneedles teknik kan betyde hurtigere diagnoser af større sygdommeSandia National Laboratories -forsker Philip Miller undersøger en mikronålenhed. Det nye enhedsdesign bruger en række nåle og kan ekstrahere 20 mikroliter interstitiel væske, sammenlignet med de to mi -
 Nye nanostrukturer til effektiv langtrækkende energitransportEn supramolekylær nanofiber bestående af mere end 10, 000 perfekt bestilte byggesten, som muliggør en energitransport over en afstand på mere end 4 mikrometer ved stuetemperatur. Kredit:A. T. Haedler.
Nye nanostrukturer til effektiv langtrækkende energitransportEn supramolekylær nanofiber bestående af mere end 10, 000 perfekt bestilte byggesten, som muliggør en energitransport over en afstand på mere end 4 mikrometer ved stuetemperatur. Kredit:A. T. Haedler.
- Den langsigtede skæbne for tropiske skove er måske ikke så alvorlig, som man troede, siger unders…
- Undersøge oprindelsen af kapperne kemisk adskilte ar
- Ikke alle skoler mod mobning virker – nogle kan faktisk gøre mobning værre
- Første violiner imiterede menneskestemmer:studie
- Biomolekylær analyse af middelalderlig pergamentfødselbælte
- Hvad betyder opløsning?


