Ny nanoenhed besejrer lægemiddelresistens
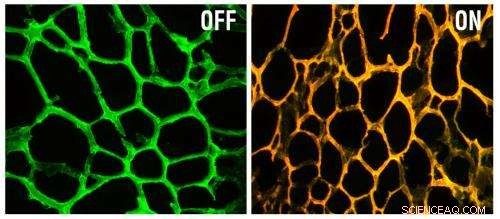
Til venstre er den nye nanoenhed, bestående af en hydrogel indlejret med guld-nanopartikler belagt med DNA rettet mod et gen kaldet MRP-1. Til højre, enheden fluorescerer efter at have stødt på målgensekvensen. Kredit:Udlånt af forskerne
Kemoterapi formindsker ofte tumorer i starten, men efterhånden som kræftceller bliver resistente over for lægemiddelbehandling, tumorer kan vokse tilbage. En ny nanoenhed udviklet af MIT-forskere kan hjælpe med at overvinde det ved først at blokere genet, der giver lægemiddelresistens, derefter lancere et nyt kemoterapiangreb mod de afvæbnede tumorer.
Enheden, som består af guld nanopartikler indlejret i en hydrogel, der kan injiceres eller implanteres på et tumorsted, kunne også bruges mere bredt til at forstyrre ethvert gen involveret i kræft.
"Du kan målrette enhver genetisk markør og levere et lægemiddel, inklusive dem, der ikke nødvendigvis involverer lægemiddelresistensveje. Det er en universel platform for dobbeltterapi, " siger Natalie Artzi, en forsker ved MIT's Institute for Medical Engineering and Science (IMES), en assisterende professor ved Harvard Medical School, og seniorforfatter til et papir, der beskriver enheden i Proceedings of the National Academy of Sciences ugen den 2. marts.
For at demonstrere effektiviteten af den nye tilgang, Artzi og kolleger testede det i mus implanteret med en type human brysttumor kendt som en tredobbelt negativ tumor. Sådanne tumorer, som mangler nogen af de tre mest almindelige brystkræftmarkører - østrogenreceptor, progesteron receptor, og Her2 - er normalt meget svære at behandle. Brug af den nye enhed til at blokere genet for multilægemiddelresistent protein 1 (MRP1) og derefter levere kemoterapilægemidlet 5-fluorouracil, forskerne var i stand til at skrumpe tumorer med 90 procent på to uger.
Overvinde modstand
MRP1 er et af mange gener, der kan hjælpe tumorceller med at blive resistente over for kemoterapi. MRP1 koder for et protein, der fungerer som en pumpe, eliminere kræftlægemidler fra tumorceller og gøre dem ineffektive. Denne pumpe virker på flere andre lægemidler end 5-fluorouracil, herunder det almindeligt anvendte kræftmiddel doxorubicin.
"Medikamentresistens er en stor forhindring i kræftbehandling og grunden til, at kemoterapi, i mange tilfælde, er ikke særlig effektiv", siger João Conde, en IMES postdoc og hovedforfatter af PNAS-papiret.
For at overvinde dette, forskerne skabte guld-nanopartikler belagt med DNA-strenge, der er komplementære til sekvensen af MRP1-budbringer-RNA - uddraget af genetisk materiale, der bærer DNA's instruktioner til resten af cellen.
Disse DNA-strenge, som forskerne kalder "nanobeacons, " fold tilbage på sig selv for at danne en lukket hårnålestruktur. når DNA'et møder den korrekte mRNA-sekvens inde i en kræftcelle, det udfolder sig og binder sig til mRNA, forhindrer det i at generere flere molekyler af MRP1-proteinet. Efterhånden som DNA'et udfolder sig, det frigiver også molekyler af 5-fluorouracil, der var indlejret i strengen. Dette lægemiddel angriber derefter tumorcellens DNA, da MRP1 ikke længere er tilstede for at pumpe det ud af cellen.
"Når vi gør genet tavse, cellen er ikke længere resistent over for det stof, så vi kan levere det lægemiddel, der nu genvinder sin effektivitet, " siger Conde.
Når hver af disse hændelser opstår – sansning af MRP1-proteinet og frigivelse af 5-fluorouracil – udsender enheden fluorescens af forskellige bølgelængder, giver forskerne mulighed for at visualisere, hvad der sker inde i cellerne. På grund af dette, partiklerne kunne også bruges til diagnose – specifikt, afgøre, om et bestemt kræftrelateret gen er aktiveret i tumorceller.
Kontrolleret lægemiddelfrigivelse
De DNA-coatede guld-nanopartikler er indlejret i en klæbende gel, der bliver på plads og dækker tumoren efter at være blevet implanteret. Denne lokale administration af partiklerne beskytter dem mod nedbrydning, der kunne opstå, hvis de blev administreret i hele kroppen, og muliggør også vedvarende lægemiddelfrigivelse, siger Artzi.
I deres musestudier, forskerne fandt ud af, at partiklerne kunne dæmpe MRP1 i op til to uger, med kontinuerlig frigivelse af lægemidler over den tid, effektivt skrumpende tumorer.
Denne tilgang kunne tilpasses til at levere enhver form for lægemiddel eller genterapi målrettet mod et specifikt gen involveret i cancer, siger forskerne. De arbejder nu på at bruge det til at dæmpe et gen, der stimulerer gastriske tumorer til at metastasere til lungerne.
 Varme artikler
Varme artikler
-
 Blyøer i et hav af grafen magnetiserer fremtidens materialeI havet af grafen (over en iridiumkrystal), elektronernes spin-kredsløbsinteraktion er meget lavere end den, der skabes ved at interkalere en blyø. Kredit:IMDEA Nanoscience/UAM/ICMM-CSIC/UPV-EHU F
Blyøer i et hav af grafen magnetiserer fremtidens materialeI havet af grafen (over en iridiumkrystal), elektronernes spin-kredsløbsinteraktion er meget lavere end den, der skabes ved at interkalere en blyø. Kredit:IMDEA Nanoscience/UAM/ICMM-CSIC/UPV-EHU F -
 Undersøgelse kaster lys over interaktioner, der ændrer den måde, varme og elektricitet bevæger s…Kredit:Massachusetts Institute of Technology Ny forskning giver indsigt i, hvordan krystaldislokationer - en almindelig type defekt i materialer - kan påvirke elektrisk og varmetransport gennem kr
Undersøgelse kaster lys over interaktioner, der ændrer den måde, varme og elektricitet bevæger s…Kredit:Massachusetts Institute of Technology Ny forskning giver indsigt i, hvordan krystaldislokationer - en almindelig type defekt i materialer - kan påvirke elektrisk og varmetransport gennem kr -
 Siliciumoxidhukommelser overskrider en forhindringEt scanningselektronmikroskopbillede viser detaljer om et 1-kilobit tværstangshukommelsesarray designet og bygget på Rice University ved hjælp af siliciumoxid som det aktive element. Kredit:Tour Group
Siliciumoxidhukommelser overskrider en forhindringEt scanningselektronmikroskopbillede viser detaljer om et 1-kilobit tværstangshukommelsesarray designet og bygget på Rice University ved hjælp af siliciumoxid som det aktive element. Kredit:Tour Group -
 Forståelse af ladningsoverførsler i molekylær elektronikEnrique del Barcos arbejde vil bidrage til at fremme forståelsen af kvanteteknologier. Kredit:University of Central Florida Et internationalt forskerhold, som omfatter University of Central Flor
Forståelse af ladningsoverførsler i molekylær elektronikEnrique del Barcos arbejde vil bidrage til at fremme forståelsen af kvanteteknologier. Kredit:University of Central Florida Et internationalt forskerhold, som omfatter University of Central Flor
- Cheerleaders hjælper med at opdage bakterier, der vokser bedre i nul-tyngdekraft
- Perovskite-solceller testet for ydeevne i den virkelige verden - i laboratoriet
- Sådan beregnes UTM Convergence
- Masker og handsker redder liv - og forårsager forurening
- Israelsk rumfartøj styrter ned i forsøg på at lande på månen
- Hvad er funktionerne ved knabler?


