Undersøgelse undersøger mekanisme for clearance af nanomateriale fra leveren
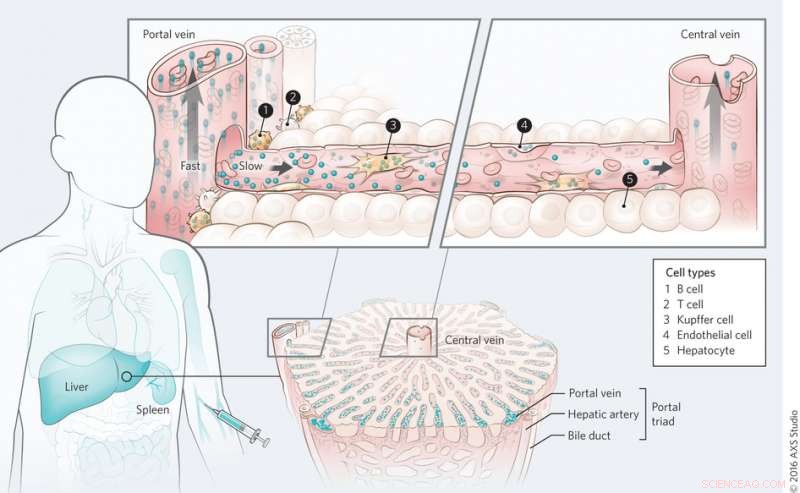
Mekanisme for nanomaterialetransport i leveren. Kredit:(c) Kim M. Tsoi, et al. Naturmaterialer (2016) doi:10.1038/nmat4718
(Phys.org) – En af de største udfordringer for at realisere potentialet i målrettede terapier er at forhindre nanomaterialer i at samle sig i leveren eller milten. Leveren og milten er en del af det mononukleære fagocytsystem. Dens opgave er at filtrere toksiner fra blodbanen. Desværre, ved at udføre sit arbejde, det forhindrer også nanoterapier i at nå deres mål.
For at overvinde denne hindring har en gruppe forskere fra adskillige institutioner i Toronto udført beregninger på organniveau og underorganniveau, in vitro, og in vivo undersøgelser ved hjælp af kvanteprikker, guld nanopartikler, og silica nanopartikler for bedre at forstå det mononukleære fagocytsystem og den mekanisme, hvorved nanopartikler sekvestreres. De fandt ud af, at blodgennemstrømningen, cellulær fænotype, og fysisk position i leveren spiller alle en rolle i optagelsen af nanopartikler. De foreslår, at fremtidigt arbejde ikke kun bør involvere design af nanopartikler, men en form for leverkonditionering. Deres arbejde vises i Naturmaterialer .
Nanopartikler kan funktionaliseres på en sådan måde, at partiklen målretter mod en bestemt celletype. Dette lover meget for kræft og andre målrettede behandlinger. Imidlertid, når nanoterapier testes i kroppen, nanopartiklerne fjernes fra blodbanen via det mononukleære fagocytsystem (MPS). Dette gælder for alle typer nanopartikler.
Tsoi, et al. udført helorgan- og underorgananalyser for bedre at forstå, hvordan MPS-systemet sekvestrerer nanopartikler. For deres eksperimenter, de fokuserede på ikke-nedbrydelige "hårde" nanopartikler:kvanteprikker, guld nanopartikler, og silica nanopartikler.
På hele orgelplan, Tsoi, et al. fandt ud af, at kvanteprikker først fjernes af cellerne nær portaltriaden, og at der er en clearancegradient gennem leverens sinusoide under den første passage. Blod strømmer ind i leveren gennem portaltriaden og ud gennem den centrale vene. Dette blev også observeret med guld nanopartikler uanset overfladefunktionalisering, selvom proteinadsorption så ud til at spille en rolle i nanopartikeloptagelsen.
Det næste undersøgelsesområde er, om blodgennemstrømningshastigheden spiller en rolle i binding af nanopartikler. Blodgennemstrømningen aftager, når den rammer leveren (fra 10-100 cm s -1 til 200-800 μm s -1 ). Tsoi, et al. udviklet en matematisk model til at beskrive blodgennemstrømningen i leveren og sandsynligheden for binding af nanopartikler. De sammenlignede derefter deres beregningsresultater med resultaterne af cytometriundersøgelser med rotterne, der blev behandlet med kvanteprikker i testen for akkumulering af nanopartikler. Især mens advektion er den dominerende indflydelse på blodgennemstrømningen i kroppen, diffusion er den dominerende indflydelse i leveren. De fandt ud af, at leveren var 10 2 til 10 3 gange større sandsynlighed for at binde nanomaterialer, og at partikelstørrelsen spillede en rolle – jo større partiklen, jo mere sandsynligt blev det absorberet af leveren.
På underorganniveau, Tsoi, et al. set på, hvilke celletyper der spiller den største rolle i nanopartikeloptagelsen. Undersøgelser for at bestemme celleoptagelse af kvanteprikker viste, at Kupffer-celler adsorberede det største volumen af kvanteprikker, som forventet. Imidlertid, hvad der var overraskende var antallet af partikler internaliseret af B-celler. B-celler ser ud til at spille en meget større rolle i nanopartikeloptagelsen, end man engang troede, selvom Kupffer-celler stadig er nøglecellerne til at fjerne nanopartikler. Andre celletyper, inklusive endotelceller, også spillet en rolle i at fjerne nanopartikler.
Næste, Tsoi, et al. testet om organarkitektur påvirker nanopartikeloptagelsen i leveren ved at studere sekvestrationsprocessen i milten. De fandt, at af de nanopartikler, der blev fjernet af milten, næsten alle af dem var placeret i den røde pulp-region. Det er her blodgennemstrømningen falder i forhold til strømmen i hele kroppen. Mens nogle nanopartikler befandt sig i milten, miltmakrofager internaliserede færre nanopartikler end Kupffer-celler i leveren. Dette blev bekræftet med sammenlignende in vitro og in vivo undersøgelser, og demonstrerer, at organarkitektur celletype spiller en rolle i nanopartikeloptagelse.
Denne forskning giver vigtig indsigt i, hvordan man kan overvinde nanopartikeloptagelse af MPS. Typisk fokuserer forskere på nanopartikeldesignet, men denne undersøgelse tyder på, at det kropslige miljø spiller en vigtig rolle i binding af nanopartikler. Forfatterne foreslår at manipulere værtsmiljøet som en komplementær strategi til nanopartikeloptimering. Foreløbige test viser, at to mulige veje er at ændre blodgennemstrømningshastigheden gennem leveren og ændre fænotypen af visse celler, så de ikke er tilbøjelige til at optage nanomateriale.
© 2016 Phys.org
 Varme artikler
Varme artikler
-
 Antioxidantforbindelser efterligner effektive grafenmidler, vise potentiale for terapierPEG-PDI, som indeholder en forbindelse, der længe har været brugt som rødt farvestof, ændres til grønlig-blå med tilsætning af kaliumsuperoxid, da det omdanner superoxidet til dioxygen. Tilføjelse af
Antioxidantforbindelser efterligner effektive grafenmidler, vise potentiale for terapierPEG-PDI, som indeholder en forbindelse, der længe har været brugt som rødt farvestof, ændres til grønlig-blå med tilsætning af kaliumsuperoxid, da det omdanner superoxidet til dioxygen. Tilføjelse af -
 Afsløring af nethinden:Graphene corneal kontaktlinse giver robust, irritationsfri topografisk elekt…Fig. 1 GRACE-enhedsfremstilling og karakterisering. -en Skematisk tegning af ERG-optagelse med GRACE-enheden. b Skematisk illustration af GRACE-fremstilling med G-kvarts og G-Cu. c Fotografier
Afsløring af nethinden:Graphene corneal kontaktlinse giver robust, irritationsfri topografisk elekt…Fig. 1 GRACE-enhedsfremstilling og karakterisering. -en Skematisk tegning af ERG-optagelse med GRACE-enheden. b Skematisk illustration af GRACE-fremstilling med G-kvarts og G-Cu. c Fotografier -
 Knækkende æggeskals nanostruktur:Ny opdagelse kan have vigtige konsekvenser for fødevaresikkerhed…Men i løbet af deres korte levetid fugleægskal ændrer deres styrke. For eksempel, de bliver tyndere og svagere, inden ruge begynder. Nu, forskere, der undersøger æggeskallestrukturen, har nulstillet p
Knækkende æggeskals nanostruktur:Ny opdagelse kan have vigtige konsekvenser for fødevaresikkerhed…Men i løbet af deres korte levetid fugleægskal ændrer deres styrke. For eksempel, de bliver tyndere og svagere, inden ruge begynder. Nu, forskere, der undersøger æggeskallestrukturen, har nulstillet p -
 Nanobowls serverer kemoterapi til kræftcellerI denne illustration, en nanobowl (lilla halvcirkel) understøtter strukturen af et liposom (blå membran-dobbeltlag) for at forhindre, at et kemoterapilægemiddel (rødt) lækker ud. Kredit: Nano bogsta
Nanobowls serverer kemoterapi til kræftcellerI denne illustration, en nanobowl (lilla halvcirkel) understøtter strukturen af et liposom (blå membran-dobbeltlag) for at forhindre, at et kemoterapilægemiddel (rødt) lækker ud. Kredit: Nano bogsta
- Strålebehandling algoritme kan reducere bivirkninger, opretholde effekt mod tumorer
- COVID-19-lockdowns afværgede titusindvis af for tidlige dødsfald relateret til luftforurening
- Mars globale støvstorm sluttede vinter tidligt i syd
- Elever på hver klasse skal lære klimavidenskab, siger ekspert
- NASAs infrarøde opfattelse afp Kraftfulde storme omkring tyfonen Norus øje
- Nasdaq forlænger acceptperioden for udveksling i Norge


