Brug af injicerbare selvsamlede nanomaterialer til vedvarende levering af lægemidler
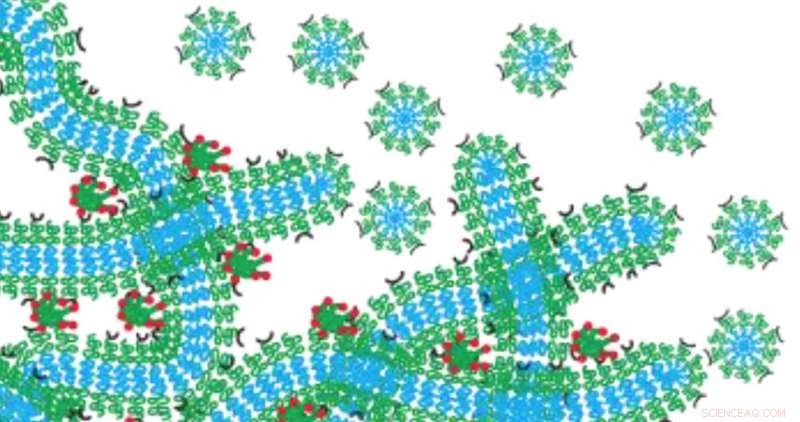
Evan Scotts hydrogel-netværk fungerer som et lægemiddeldepot, der langsomt nedbrydes ved at nedbrydes til miceller. Kredit:Northwestern University
Fordi de kan programmeres til at rejse rundt i kroppen og selektivt målrette mod kræft og andre sygdomssteder, nanometer-skala køretøjer kaldet nanocarriers kan levere højere koncentrationer af lægemidler til at bombardere specifikke områder af kroppen og samtidig minimere systemiske bivirkninger. Nanobærere kan også levere lægemidler og diagnostiske midler, der typisk ikke er opløselige i vand eller blod, samt reducere den effektive dosis betydeligt.
Selvom denne metode kan virke ideel til behandling af sygdomme, nanobærere er ikke uden deres udfordringer.
"Kontrolleret, vedvarende fødsel er fordelagtig til behandling af mange kroniske lidelser, men dette er svært at opnå med nanomaterialer uden at inducere uønsket lokal betændelse, " sagde Northwestern Universitys Evan Scott. "I stedet, nanomaterialer administreres typisk som flere separate injektioner eller som en transfusion, der kan tage mere end en time. Det ville være fantastisk, hvis læger kunne give én indsprøjtning, som kontinuerligt frigav nanomaterialer over en kontrolleret periode."
Nu Scott, en assisterende professor i biomedicinsk teknik i Northwesterns McCormick School of Engineering, har udviklet en ny mekanisme, der gør det kontrolleret, vedvarende levering mulig.
Scotts team designet en nanocarrier-formulering, der - efter hurtigt at være blevet til en gel inde i kroppen på injektionsstedet - kontinuerligt kan frigive nanoskala lægemiddelfyldte vehikler i månedsvis. Selve gelen samles igen i nanobærerne, så efter at alt lægemidlet er blevet leveret, intet restmateriale efterlades til at fremkalde betændelse eller dannelse af fibrøst væv. Dette system kunne, for eksempel, muliggør enkeltadministrationsvacciner, der ikke kræver boostere, samt en ny måde at levere kemoterapi på, hormonbehandling, eller lægemidler, der letter sårheling.
Støttet af National Science Foundation og National Institutes of Health, undersøgelsen blev offentliggjort online i dag, 12. februar i journalen Naturkommunikation . Nicholas Karabin, en kandidatstuderende i Scotts laboratorium, var avisens første forfatter. Northwestern Engineering's Kenneth Shull, professor i materialevidenskab og teknik, også bidraget til arbejdet. Medlem af Northwesterns Simpson Querrey Institute for BioNanotechnology and Chemistry of Life Processes Institute, Scott var tilsvarende forfatter og ledede udviklingen af nanopartikler og in vivo validering.
I øjeblikket, de mest almindelige vedvarende nanocarrier-leveringssystemer holder nanomaterialer i polymermatricer. Disse netværk implanteres i kroppen, hvor de langsomt frigiver de fangede stofbærere over en periode. Problemet ligger efter leveringen er afsluttet:netværkene forbliver inde i kroppen, fremkalder ofte et fremmedlegemssvar. Det resterende netværk kan give ubehag og kronisk betændelse hos patienten.
For at omgå dette problem, Scott udviklede en nanocarrier ved hjælp af selvmonterede, filamentformede nanomaterialer, som er fyldt med et lægemiddel eller billeddannende middel. Når de er tværbundet sammen, filamenterne danner et hydrogel-netværk, der ligner strukturelt væv i den menneskelige krop. Efter at filamenterne er injiceret i kroppen, det resulterende hydrogel-netværk fungerer som et lægemiddeldepot, der langsomt nedbrydes ved at nedbrydes til sfæriske nanomaterialer kaldet miceller, som er programmeret til at rejse til specifikke mål. Fordi netværket omdannes til lægemiddelleveringssystemet, intet er mindre bagud for at forårsage betændelse.
"Alt materiale rummer stoffet og afgiver derefter stoffet, Scott forklarede. "Det nedbrydes på en kontrolleret måde, resulterer i nanomaterialer, der har samme form og størrelse. Hvis vi fylder et lægemiddel i filamenterne, micellerne tager stoffet og går med det. "
Efter at have testet systemet både in vitro og in vivo i en dyremodel, Scotts team demonstrerede, at de kunne administrere en subkutan injektion, der langsomt leverede nanomaterialer til celler i lymfeknuder i over en måned på en kontrolleret måde.
Scott sagde, at systemet kan bruges til andre nanostrukturer ud over miceller. For eksempel, systemet kunne omfatte vesikelformede nanopartikler, såsom liposomer eller polyersomer, der har stoffer, proteiner, eller antistoffer fanget inde. Forskellige vesikler kan bære forskellige lægemidler og frigive dem med forskellige hastigheder, når de først er inde i kroppen.
"Dernæst leder vi efter måder at skræddersy systemet til behovene for specifikke sygdomme og terapier, " sagde Scott. "Vi arbejder i øjeblikket på at finde måder at levere kemoterapeutika og vacciner på. Kemoterapi kræver normalt levering af flere giftige lægemidler i høje koncentrationer, og vi kunne levere alle disse lægemidler i én injektion i meget lavere doser. Til immunisering, disse injicerbare hydrogeler kunne administreres som standardvacciner, men stimulerer specifikke celler i immunsystemet i længere tid, kontrollerede perioder og potentielt undgå behovet for boostere."
 Varme artikler
Varme artikler
-
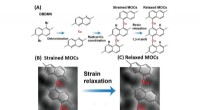 Stammeinduceret isomerisering af molekylære kæderFigur (A) giver en skematisk illustration af syntesen af metal-organiske kæder (MOCer) og deres strukturelle afslapning på et kobbersubstrat. Forbindelse 1, 5-dibromo-2, 6-dimethylnaphthalen (DBDMN)
Stammeinduceret isomerisering af molekylære kæderFigur (A) giver en skematisk illustration af syntesen af metal-organiske kæder (MOCer) og deres strukturelle afslapning på et kobbersubstrat. Forbindelse 1, 5-dibromo-2, 6-dimethylnaphthalen (DBDMN) -
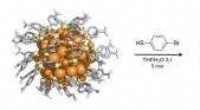 Nye strukturelle oplysninger om funktionalisering af guld nanopartiklerDette er en visualisering af atomstrukturen i Au102 (p-MBA) 44-partiklen (til venstre) og den delvist ligandbyttede Au102 (p-MBA) 40 (p-BBT) 4 (højre). Den udvekslede ligandbrombenzenthiol (p-BBT) er
Nye strukturelle oplysninger om funktionalisering af guld nanopartiklerDette er en visualisering af atomstrukturen i Au102 (p-MBA) 44-partiklen (til venstre) og den delvist ligandbyttede Au102 (p-MBA) 40 (p-BBT) 4 (højre). Den udvekslede ligandbrombenzenthiol (p-BBT) er -
 Nanomaterialer klar til stor indflydelse i byggerietRice Universitys Pedro Alvarez (til venstre) og Jaesang Lee gennemgik mere end 140 videnskabelige artikler for at undersøge byggeindustriens potentielle anvendelser af nanomaterialer. Kredit:Jeff Fitl
Nanomaterialer klar til stor indflydelse i byggerietRice Universitys Pedro Alvarez (til venstre) og Jaesang Lee gennemgik mere end 140 videnskabelige artikler for at undersøge byggeindustriens potentielle anvendelser af nanomaterialer. Kredit:Jeff Fitl -
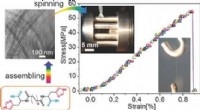 Kemiteamet skaber spontant dannende supramolekylært nanorørsgarn(Phys.org) – Et team af kemikere fra det kinesiske videnskabsakademi i Beijing har skabt et alternativ til kulstofnanorør. I deres papir offentliggjort i tidsskriftet Avancerede materialer , forsker
Kemiteamet skaber spontant dannende supramolekylært nanorørsgarn(Phys.org) – Et team af kemikere fra det kinesiske videnskabsakademi i Beijing har skabt et alternativ til kulstofnanorør. I deres papir offentliggjort i tidsskriftet Avancerede materialer , forsker


