Forsker udvikler hybrid nano-probe, der kan detektere levende kræftceller
USC Dornsifes Fabien Pinaud og hans kolleger udvikler ny teknologi til selektivt at identificere individuelle levende kræftceller. Kredit:Sammensat billede af Matthew Savino
Fabien Pinauds store vision for behandling af kræfthjem på de mindste mål.
Sammen med et team af videnskabsmænd, han skabte en ny hybrid nano-probe, der kunne føre til ikke-invasiv påvisning og behandling af sygdommen på niveau med en enkelt celle.
Pinaud, adjunkt i biologiske videnskaber, kemi og fysik og astronomi ved USC Dornsife, udviklet en metode til at forstærke et biokemisk signal på overfladen af kræftceller.
Den nye teknik binder og samler guldnanopartikler i levende celler ved hjælp af to fragmenter af et fluorescerende protein som "molekylær lim". Disse små prober fungerer som forstærkere, forbedring af forskernes evne til at opdage forskellige biomarkører - ting som overudtrykte eller muterede proteiner - der findes i kræftceller.
Det forstærkede signal gør det muligt for forskerne at skelne kræftceller fra raske celler ved hjælp af Raman-spektroskopi - en specialiseret laserbilleddannelsesteknik.
"Vores tilgang udnytter det faktum, at vi har to forskellige nanopartikler, som på egen hånd, ikke er aktive, men som bliver aktive, når de samles på kræftceller, " sagde Pinaud, hovedefterforsker af Single Molecule Biophotonics Group og medforfatter af en relateret undersøgelse, udgivet 9. februar i Naturkommunikation .
Lige på målet
Brug af "molekylær lim" -aggregater til at designe nye nanosonder er almindelig praksis inden for biomedicinsk forskning i dag, men de fleste videnskabsmænd bygger disse med DNA i stedet for protein. Mens lovende optiske sonder genereres ved hjælp af DNA -samlinger i reagensglas, DNA er ikke et praktisk klæbemiddel i levende celler. Proteiner er ofte bedre.
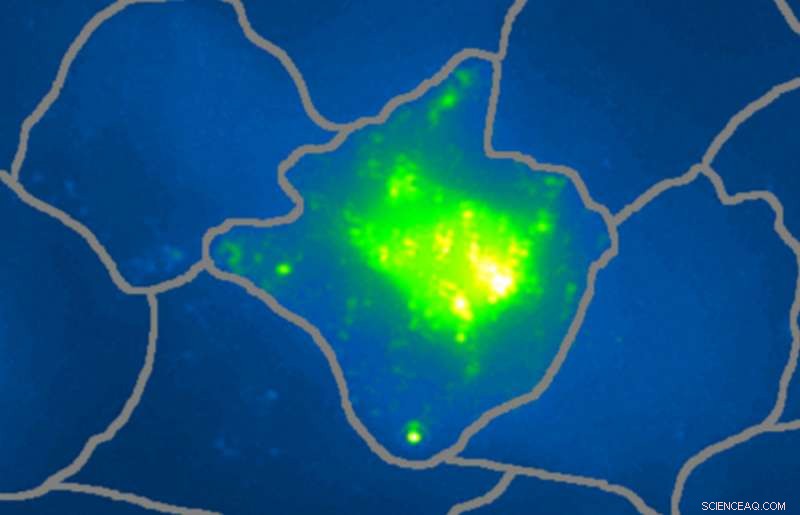
Nye hybride nano-prober, der samler sig selv ved genkendelse af overudtrykte cellulære biomarkører, giver dobbelt-detektion af individuelle cancerceller ved Raman og fotoakustisk billeddannelse. Kredit:Fabien Pinaud
Pinaud og hans team starter med et fluorescerende protein, en, der lyser, når ultravioletblåt lys skinner på den. Det fluorescerende protein opdeles i to fragmenter, og hvert stykke er knyttet til et sæt guld-nanopartikler. Begge sæt af nanopartikler nul-ind på celler og binder specifikt til biomarkører på celleoverfladen. Når nanopartiklerne kolliderer på en kræftcelle, proteinfragmenterne samles naturligt igen til hele det fluorescerende protein.
Omstruktureringsprocessen giver to fordele. Først, aktiveringen af et nyt biokemisk signal i det fluorescerende protein forstærkes massivt af nanopartiklerne, som giver mulighed for detektion ved Raman-billeddannelse.
Sekund, varme og ultralyd produceres, når laseren rammer nanopartiklerne, og det kan måles med ultralydsdetektorer. Denne dobbelte effekt giver høj sikkerhed for, at en detekteret celle faktisk er kræftfremkaldende og ikke et falsk-positivt signal fra en rask celle.
Forskere vil derefter undersøge muligheden for at ødelægge individuelle kræftceller, mens de efterlader sunde celler uskadte, ved at bruge laseren til at varme nanopartiklerne op. "At gå fra billeddannelse til at dræbe celler handler bare om at dreje knappen på den laser, du bruger, " sagde Pinaud.
Nysgerrighed nærer konvergens
Pinaud udførte forskningen sammen med sin tidligere kandidatstuderende og medforfatter, Tuğba Köker, Ph.D. Efter at have uddannet sig som biolog i Tyrkiet, Köker læste et papir udgivet af Pinaud i 2011, der lagde grunden til denne fluorescerende proteinforskning. Hun mailede ham om muligheden for at arbejde sammen om projektet som en del af hendes kandidatstudier.
"Jeg var på flyet den næste uge, "Sagde Köker.
Hun husker den dag, hvor hun modtog de første laboratoriebilleder, der viser deres forsøgs succes. "Jeg kunne ikke tro det. Det var gennembrudsøjeblikket."
Mens Pinaud var spændt, hun sagde, at han også var skeptisk. "Sådan er Fabien. Han vil altid have mere sikkerhed."
Sidste artikelFor nanomedicin, cellekøn betyder noget
Næste artikelRevolutionerende nyt filter kan forbedre drikkevandskvaliteten
 Varme artikler
Varme artikler
-
 Siliciumbaserede nanopartikler kunne gøre LED'er billigere, grønnere at producereLumiSands medstifter Chang-Ching Tu, venstre, og Ji Hoo med en demo, der viser varmeren, blødere nuance af LED-pæren (venstre side), efter at en film indlejret med deres rødemitterende siliciumnanopar
Siliciumbaserede nanopartikler kunne gøre LED'er billigere, grønnere at producereLumiSands medstifter Chang-Ching Tu, venstre, og Ji Hoo med en demo, der viser varmeren, blødere nuance af LED-pæren (venstre side), efter at en film indlejret med deres rødemitterende siliciumnanopar -
 Ingeniør afslører nyt spin på fremtiden for transistorer med nyt designSpin logikport i helt carbon. Kredit: Naturkommunikation (2017). DOI:10.1038/ncomms15635 En ingeniør fra Erik Jonsson School of Engineering and Computer Science ved University of Texas i Dallas h
Ingeniør afslører nyt spin på fremtiden for transistorer med nyt designSpin logikport i helt carbon. Kredit: Naturkommunikation (2017). DOI:10.1038/ncomms15635 En ingeniør fra Erik Jonsson School of Engineering and Computer Science ved University of Texas i Dallas h -
 Fleksibel, biologisk nedbrydelig enhed kan generere strøm fra berøringLangvarige bekymringer om bærbar elektronik omfatter enhedernes korte batterilevetid og deres bidrag til e-affald. En gruppe videnskabsmænd arbejder nu på en måde at løse begge disse tilsyneladende ik
Fleksibel, biologisk nedbrydelig enhed kan generere strøm fra berøringLangvarige bekymringer om bærbar elektronik omfatter enhedernes korte batterilevetid og deres bidrag til e-affald. En gruppe videnskabsmænd arbejder nu på en måde at løse begge disse tilsyneladende ik -
 Resonans-raman-spektroskopi med 1-nanometer opløsningFig. 1:Skematisk over spidsforstærket resonans Raman spredningsmåling. Raman-spredning med spidsforstærket resonans måles af en sølvspids fremstillet ved fræsning med fokuseret ionstråle (FIB). Lokali
Resonans-raman-spektroskopi med 1-nanometer opløsningFig. 1:Skematisk over spidsforstærket resonans Raman spredningsmåling. Raman-spredning med spidsforstærket resonans måles af en sølvspids fremstillet ved fræsning med fokuseret ionstråle (FIB). Lokali
- Oprettelse og tilpasning af materiale i atomskala
- Vejbygningstogt i Papua Ny Guinea truer miljøet, samfund og økonomi
- Mars' mørke klitter:Moreux-krateret
- Ny forskning forudsiger skredgrænser to uger før de sker
- Eksempler på tæthedsafhængige faktorer
- Billede:Hubble beundrer en ungdommelig kugleformet stjernehob


