Autonom genekspressionskontrol nanoenhed vil bidrage til medicinsk behandling
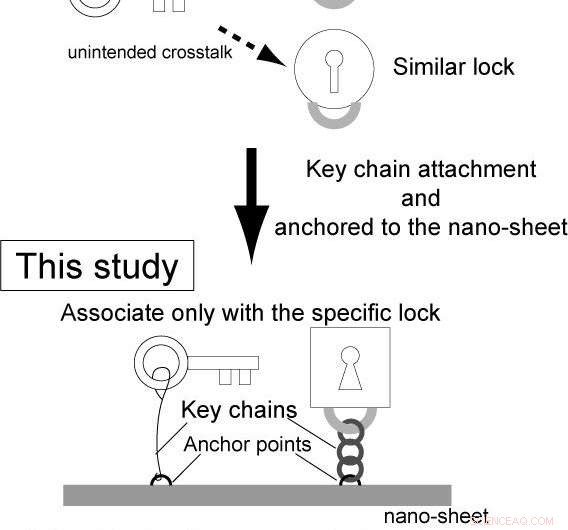
Fig. 1 Effekt af integrationstilgang. Kredit:Hisasi Tadakuma / Osaka University
Genekspression er en grundlæggende del af livet, hvor hver celle tænder og slukker for specifikke gener. Dermed, en autonom enhed, der kunne styre tænd/sluk-kontakten, ville have stor værdi i medicinsk behandling.
Syntetiske genetiske kredsløb er en teknologi til at kontrollere genekspression og programmere celler til at udføre ønskede funktioner. Derfor, at øge kompleksiteten af det genetiske kredsløb vil give os mulighed for at kontrollere celleskæbner mere præcist.
Imidlertid, kompleksiteten af genetiske kredsløb er fortsat lav. Dette er fordi, i konventionelle reaktionsdiffusionssystemer, enzymerne og substraterne leveres separat, og ikke-specifik binding af enzymerne til substraterne forårsager utilsigtet krydstale mellem de forskellige kredsløb.
Osaka University ledede forskere, i et fælles forskningsprojekt med University of Tokyo, Kyoto Universitet, og Waseda University, konstruerede integrerede genlogik-chips kaldet "gen-nanochips". Ved at bruge integrerede faktorer på nanochips, disse selvstændige nanochips kan tænde og slukke for gener inden for en enkelt chip, forhindrer utilsigtet krydstale.
Forskerne viste de autonome reaktioner fra nanochips i kunstige celler:miljøsansning, informationsberegning og produktoutput på enkelt-chip-niveau. Deres forskningsresultater blev offentliggjort i Natur nanoteknologi .
DNA-nanoteknologi er en alsidig metode, der bruges til at konstruere brugerdefinerede strukturer og til at kontrollere præcise molekylære layouts. Forskerne brugte et rektangulært ark (90 nm bredt, 60 nm dyb, 2 nm høj), og integreret enzym, RNA polymerase (RNAP, et enzym, der syntetiserer RNA fra en DNA-skabelon), og multiple målgensubstrater.
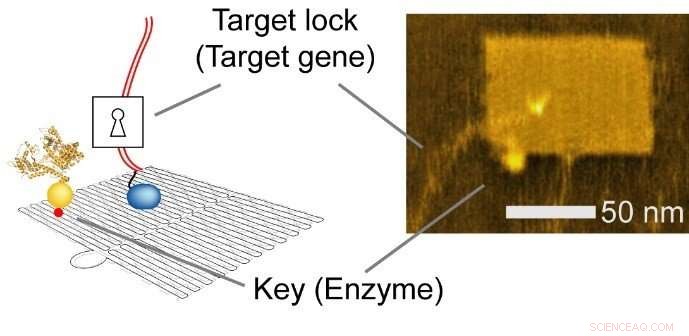
Fig. 2 Integreret nanochip. Venstre, Skematisk illustration. Ret, atomic force microscopy (AFM) billede. Kredit:Hisashi Tadakuma / Osaka University
DNA-nanoteknologiens nano-layout-evne gør det muligt for forskeren at designe genekspressionsniveauer rationelt ved at ændre de intermolekylære afstande mellem enzymet og målgenerne, påvirker således kollisionseffektiviteten og efterfølgende reaktion.
Forskerne integrerede sensorer yderligere. Ideelt set en sensor, der er i stand til at detektere enhver type signal, bør have minimale designbegrænsninger. Imidlertid, konventionelle metoder har lidt af adskillige begrænsninger (f.eks. materialer). Dette er fordi, i konventionelle genetiske kredsløb, sensoren er en del af enzymets substrat (f.eks. DNA i transkription; se note for detaljer).
Omvendt i dette studie, sensordelen var uafhængig af den enzymatiske reaktion. Dermed, forskerne kan bruge ethvert sensormateriale, der ændrer den effektive intermolekylære afstand ved signalgenkendelse, tillader konstruktion af forskellige sensorer, der reagerer på forskellige signaler (mikroRNA'er, kemiske forbindelser, proteiner og lys). I øvrigt, ved at kombinere og integrere sensorer, der reagerer på forskellige signaler, forskerne er lykkedes med foto-omprogrammering af de genetiske kredsløb.
Endelig, nanochippen gjorde det muligt for forskerne at forenkle konstruktionen af et genetisk kredsløb, der reagerede på en kunstig celle, en dråbe vand-i-olie, og de kunne beregne dens miRNA-profil, ved blot at blande de ortogonale chips, udvidelse af kraften i det genetiske kredsløb.
Den korresponderende forfatter Hisashi Tadakuma siger, "Alle faktorer, der er nødvendige for transkriptionsreaktioner, er på denne integrerede nanochip, så miljøsans, informationsberegning, og produktoutput kan fuldføres på enkelt-chip-niveau. I den nærmeste fremtid, autonome nanochips vil være nyttige til at opretholde cellen i en sund tilstand ved at kontrollere genekspression rumligt og tidsmæssigt, som vil legemliggøre idealet om ordsproget "forebyggelse er den bedste kur". "
Ideelt set en sensor, der er i stand til at detektere enhver type signal, bør have minimale designbegrænsninger. Imidlertid, konventionelle metoder har lidt af adskillige begrænsninger (f.eks. materialer). Dette er fordi, i konventionelle genetiske kredsløb, effektiviteten af binding mellem et enzym såsom RNAP (nøgle) og et målgen (target lock), specifikt en promotorsekvens på DNA-molekylet, er styret af transkriptionsfaktorer (regulatorer). Da regulatorer og enzymer bør binde sig til sensoren (operatørområdet) nær mållåsen, sensorens materiale skal være et substrat for regulatorer og enzymer (f.eks. DNA i transkription), og regulatoren skal være et DNA-bindende protein. Dermed, både regulator (signal) og sensor har materialebegrænsninger.
Imidlertid, i dette studie, bindingsfrekvensen og den efterfølgende reaktion styres af (1) den intermolekylære afstand mellem et enzym og et målgen, og (2) nøgleringens egenskaber (f.eks. stivhed, længde). Sensordelen er således uafhængig af den enzymatiske reaktion, og sensoren og regulatorerne har ingen materielle begrænsninger, gør det muligt for de forskellige sensorer at reagere på forskellige signaler (kemiske forbindelser, proteiner og lys).
 Varme artikler
Varme artikler
-
 Nano-dekorationer i naturens underjordiske vandfilterEksperimenter (venstre) og simuleringer (højre) af kolloid vedhæftning til et sedimentkorn under gunstige (øverste) og ugunstige (nederst) bindingsforhold. De eksperimentelle videoer viser polystyren-
Nano-dekorationer i naturens underjordiske vandfilterEksperimenter (venstre) og simuleringer (højre) af kolloid vedhæftning til et sedimentkorn under gunstige (øverste) og ugunstige (nederst) bindingsforhold. De eksperimentelle videoer viser polystyren- -
 Forskerteam udvikler nye kompakte og energieffektive nanoskala mikrobølgeoscillatorerKredit:SINANO Ved at bruge forbedrede magnetiske materialer, baseret på kontrol af grænsefladeegenskaber for ultratynde magnetiske film, forskere fra Suzhou Institute of Nano-tech og Nano-bionics,
Forskerteam udvikler nye kompakte og energieffektive nanoskala mikrobølgeoscillatorerKredit:SINANO Ved at bruge forbedrede magnetiske materialer, baseret på kontrol af grænsefladeegenskaber for ultratynde magnetiske film, forskere fra Suzhou Institute of Nano-tech og Nano-bionics, -
 Kohærent elektronbanekontrol i grafenDet drivende laserfelt (rødt) ryster elektroner i grafen på ultrakorte tidsskalaer, vist som violette og blå bølger. En anden laserimpuls (grøn) kan styre denne bølge og dermed bestemme strømmens retn
Kohærent elektronbanekontrol i grafenDet drivende laserfelt (rødt) ryster elektroner i grafen på ultrakorte tidsskalaer, vist som violette og blå bølger. En anden laserimpuls (grøn) kan styre denne bølge og dermed bestemme strømmens retn -
 Pakning af elektroner i en nanoboks:Kontrol af mange-Krop-korrelation ved kvanteindeslutningFig. 1 Atomic force mikroskop billede af GaAs kvanteprikker brugt i denne forskning. Et team ledet af Dr. Takashi Kuroda, Seniorforsker, og Dr. Marco Abbarchi, Forsker, fra Quantum Dot Research Ce
Pakning af elektroner i en nanoboks:Kontrol af mange-Krop-korrelation ved kvanteindeslutningFig. 1 Atomic force mikroskop billede af GaAs kvanteprikker brugt i denne forskning. Et team ledet af Dr. Takashi Kuroda, Seniorforsker, og Dr. Marco Abbarchi, Forsker, fra Quantum Dot Research Ce
- Uber går sammen med det japanske taxafirma for at knække hårde markeder
- Sådan inspicer du et hjem før Buying
- Forskere fanger lys i en tragt
- Gamle caribiske børn hjalp med indkøb i 400 e.Kr
- Facebooks kryptokurrency:en økonomisk ekspert bryder den ned
- Undersøgelse afslører tab på 10, 300 års Kiwi-liv fra den sydafrikanske krig


