Kraftfuldt mikroskop fanger det første billede af nanoscaffold, der fremmer cellebevægelse
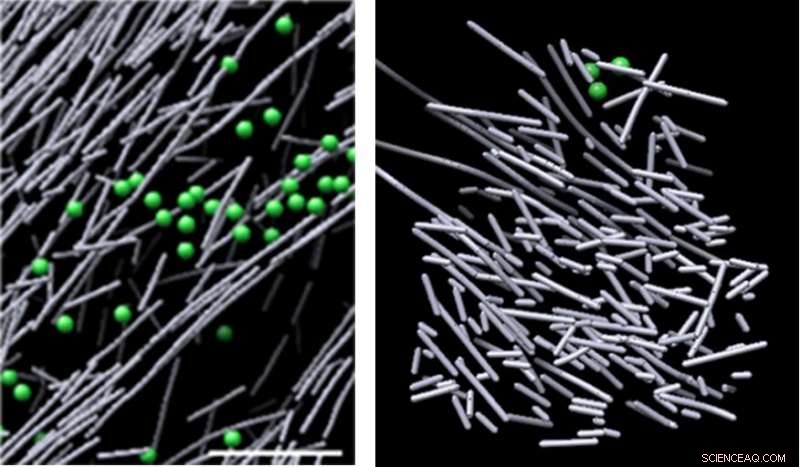
Kryo-elektronmikroskopbilleder af actinsamling i cellen i fravær af et molekylært signal (til venstre) og den høstakkenlignende aktinfilament nanoskaffel, der blev induceret som reaktion på et molekylært signal (Rac1) og fremmer cellebevægelse (til højre). Strukturen kom til syne i definerede områder, hvor Rac1 blev aktiveret, og forsvandt hurtigt, da Rac1-signalering stoppede-på så lidt som to et halvt minut. Kredit:Sanford Burnham Prebys Medical Discovery Institute (SBP)
Der er mange gange, hvor vores celler skal bevæge sig. Mobilceller styrer vores krops dannelse (embryonal udvikling). Immunceller strejfer rundt for at fange uønskede ubudne gæster. Og helbredende celler (fibroblaster) migrerer for at reparere sår. Men ikke al bevægelse er ønskelig:Tumorer er farligst, når kræftceller opnår evnen til at rejse gennem hele kroppen (metastase). Visse bakterier og vira kan udnytte cellernes motilitetsmaskineri til at invadere vores kroppe. At forstå, hvordan celler bevæger sig-og de stavlignende aktinfilamenter, der driver processen-er nøglen til at lære at standse eller fremme motilitet for at forbedre menneskers sundhed.
Nu, ved hjælp af et af de mest kraftfulde mikroskoper i verden, forskere fra Sanford Burnham Prebys Medical Discovery Institute (SBP) og University of North Carolina at Chapel Hill (UNC-Chapel Hill) har identificeret en tæt, dynamisk og uorganiseret aktinfilament nanoskaffel - der ligner en høstak - der induceres som reaktion på et molekylært signal. Det er første gang, forskere har visualiseret direkte, på molekylært niveau, en struktur, der udløses som reaktion på et cellulært signal - et centralt fund, der udvider vores forståelse af, hvordan celler bevæger sig. Undersøgelsen blev offentliggjort i Procedurer fra National Academy of Sciences af Amerikas Forenede Stater ( PNAS ).
"Cyro-elektronmikroskopi revolutionerer vores forståelse af cellers indre funktion, "siger Dorit Hanein, Ph.d., seniorforfatter af papiret og professor i programmet Bioinformatik og strukturbiologi ved SBP. "Denne teknologi tillod os at indsamle robuste, 3D-billeder af celleregioner-ligner MR, som skaber detaljerede billeder af vores krop. Vi var i stand til at visualisere celler i deres naturlige tilstand, som afslørede en aldrig før set aktin-nano-arkitektur i cellen. "
I undersøgelsen, forskerne brugte SBP's kryo-elektronmikroskop (Titan Krios), kunstig intelligens (AI) og skræddersyede beregnings- og celledannelsesmetoder til sammenligning af nanoskala billeder af musefibroblaster med tidsstemplede lysbilleder af fluorescerende Rac1, et protein, der regulerer cellens bevægelse, reaktion på kraft eller belastning (mekanosensering) og patogen invasion. Denne teknisk komplekse arbejdsgang - som broede fem størrelsesordener i skala (titalls mikron til nanometer) - tog år at udvikle sig til sit nuværende niveau af robusthed og nøjagtighed og blev muliggjort gennem eksperimentelle og beregningsmæssige bestræbelser fra strukturbiologteamene på SBP og biosensorteamet på UNC-Chapel Hill.
Billederne afslørede en tæt pakket, uorganiseret, stilladslignende struktur bestående af korte aktinstænger. Disse strukturer kom til syne i definerede områder, hvor Rac1 blev aktiveret, og forsvandt hurtigt, da Rac1 -signalering stoppede - på så lidt som to et halvt minut. Dette dynamiske stillads stod i skarp kontrast til forskellige andre aktinsamlinger i områder med lav Rac1 -aktivering - nogle består af lange, justerede aktinstænger, og andre bestående af korte aktinstænger, der forgrener sig fra siderne af længere aktinfilamenter. Volumenet, der omslutter actin -stilladset, var blottet for almindelige cellulære strukturer, såsom ribosomer, mikrotubuli, vesikler og mere, sandsynligvis på grund af strukturens intense densitet.
"Vi var overraskede over, at eksperiment efter eksperiment afslørede disse unikke hotspots med ujusterede, tæt pakket aktin stænger i regioner, der korrelerede med Rac1 aktivering, siger Niels Volkmann, Ph.d., en medkorresponderende forfatter til papiret, der ledede den beregningsmæssige del af undersøgelsen, og professor i programmet Bioinformatik og strukturbiologi ved SBP. "Vi mener, at denne lidelse faktisk er stilladsets styrke - det giver fleksibilitet og alsidighed til at bygge større, komplekse aktinfilamentarkitekturer som reaktion på yderligere lokale rumlige signaler. "
Næste, forskerne vil gerne udvide protokollen for at visualisere flere strukturer, der er skabt som reaktion på andre molekylære signaler og for yderligere at udvikle teknologien til at give adgang til andre områder af cellen.
"Denne undersøgelse er kun begyndelsen. Nu hvor vi udviklede denne kvantitative nanoskala-arbejdsgang, der korrelerer dynamisk signaladfærd med nanoskalaopløsningen af elektron-kryotomografi, vi og flere forskere kan implementere dette kraftfulde analyseværktøj ikke kun til at dechiffrere cellens bevægelses indre virke, men også til at belyse dynamikken i mange andre makromolekylære maskiner i et uforstyrret cellulært miljø, «siger Hanein.
Hun tilføjer, "Actin er et byggesten-protein; det interagerer med mere end 150 actinbindende proteiner for at generere forskellige strukturer, hver tjener en unik funktion. Vi har et overskud af forskellige signaler, som vi gerne vil kortlægge, som kunne give endnu mere indsigt i, hvordan celler bevæger sig. "
 Varme artikler
Varme artikler
-
 Superlet grafen og keramisk metamateriale har høj styrke, andre egenskaberEt nyt kompositmateriale kombinerer ultralet med flammebestandighed, superelasticitet og andre egenskaber, der kunne gøre den ideel til forskellige applikationer. Her, materialet ses med et scanningse
Superlet grafen og keramisk metamateriale har høj styrke, andre egenskaberEt nyt kompositmateriale kombinerer ultralet med flammebestandighed, superelasticitet og andre egenskaber, der kunne gøre den ideel til forskellige applikationer. Her, materialet ses med et scanningse -
 Næste generation af syntetiske kovalente 2-D materialer afsløretKredit:University of Manchester Et team af forskere ved National Graphene Institute ved University of Manchester har udviklet en ny metode til at syntetisere 2-D materialer, der menes at være umul
Næste generation af syntetiske kovalente 2-D materialer afsløretKredit:University of Manchester Et team af forskere ved National Graphene Institute ved University of Manchester har udviklet en ny metode til at syntetisere 2-D materialer, der menes at være umul -
 Russiske forskere undersøger mulighederne for at skabe fotoniske integrerede kredsløbFig. 1. (a) Illustration af en overfladeplasmon, der formerer sig langs et grafenark. (b) Tidsafhængighed af grafenbærertætheden. (c) Dispersionsdiagram, der viser frekvenstransformationen af den in
Russiske forskere undersøger mulighederne for at skabe fotoniske integrerede kredsløbFig. 1. (a) Illustration af en overfladeplasmon, der formerer sig langs et grafenark. (b) Tidsafhængighed af grafenbærertætheden. (c) Dispersionsdiagram, der viser frekvenstransformationen af den in -
 Gas giver laser-induceret grafen super egenskaberLaser-induceret grafen skabt i nærvær af argongas er superhydrofob, hvilket betyder at den undgår vand. Processen udviklet på Rice University laver materialer, der kan være superhydrofile eller superh
Gas giver laser-induceret grafen super egenskaberLaser-induceret grafen skabt i nærvær af argongas er superhydrofob, hvilket betyder at den undgår vand. Processen udviklet på Rice University laver materialer, der kan være superhydrofile eller superh
- Naturressourcer værdsat forskelligt af mænd og kvinder, undersøgelse viser
- Sådan nedbrydes en divisionsproblem
- Rapporten opfordrer regeringen til at styrke Stoke-on-Trent-økonomien
- En ny tilgang til at opdage planeter i Alpha Centauri-systemet
- Opsluger af planeter? Forskere døber stjernen Kronos
- Forskere finder, at stress under graviditeten påvirker barnets størrelse


