Nanoskala magnetisk billeddannelse af ferritin i en enkelt celle
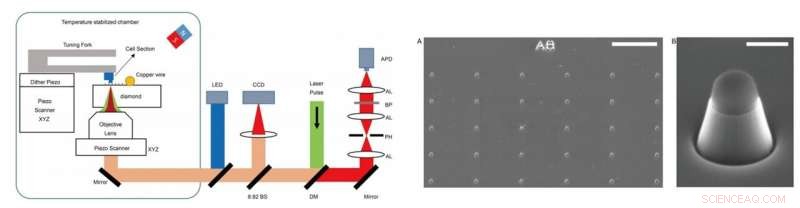
VENSTRE - Eksperimentel opsætning. Eksperimentet blev udført på et hjemmebygget setup, som kombinerede optisk detekteret magnetisk resonansmikroskopi (ODMR) med atomkraftmikroskopi (AFM). DM:dikroisk spejl. BP:Båndpasfilter, der arbejder ved 650–775 nm. APD:lavinefotodiode. CCD:ladekoblet enhed. LED:lysdiode på 470 nm. AL:akromatisk linse. PH:nålehul ved en størrelse på 30 μm. BS:stråledeler. TIL HØJRE - Billeder af nanopillerne på diamanter. (A) SEM-billeddannelse af de fremstillede diamantnanopiller lige efter reaktiv ionætsning (RIE). Toppen af nanopillaren er dækket af hydrogensilsesquioxan (HSQ) for at beskytte NV-centret. (B) En enkelt trapez-cylinderformet nanopøjle til at føle cellesektioner, der er klæbet ved AFM-spidsen. Skala barer, 10 μm (A); 400 nm (B). Kredit:Science Advances, doi:10.1126/sciadv.aau8038.
Inden for biovidenskab, evnen til at måle fordelingen af biomolekyler inde i en celle in situ er et vigtigt efterforskningsmål. Blandt en række forskellige teknikker, videnskabsmænd har brugt magnetisk billeddannelse (MI) baseret på nitrogenvacancy center (NV) i diamanter som et kraftfuldt værktøj i biomolekylær forskning. Imidlertid, nanoskala billeddannelse af intracellulære proteiner har været en udfordring indtil videre. I en nylig undersøgelse offentliggjort i Videnskabens fremskridt , Pengfei Wang og kolleger ved de tværfaglige afdelinger for fysik, biomakromolekyler, kvanteinformation og biovidenskab i Kina, brugte ferritinproteiner til at demonstrere MI-realiseringen af endogene proteiner i en enkelt celle, ved at bruge nitrogen-vacancy-centret (NV) som sensor. De afbildede intracellulære ferritiner og ferritinholdige organeller ved hjælp af MI og korrelativ elektronmikroskopi for at bane vejen for nanoskala magnetisk billeddannelse (MI) af intracellulære proteiner.
Forøgelse af eksisterende rumlig opløsning af biomedicinsk billeddannelse er påkrævet for at opnå løbende krav inden for medicinsk billeddannelse, og derfor, blandt en række forskellige teknikker, magnetisk billeddannelse er af bred interesse i øjeblikket. Magnetisk resonansbilleddannelse (MRI) bruges i vid udstrækning til at kvantificere fordelingen af nukleare spins, men konventionel MRI kan kun nå en opløsning på 1 µm i nuklear spin-billeddannelse, hvor opløsningen er begrænset af elektrisk detektionsfølsomhed. Forskere har udviklet en række teknikker til at bryde denne opløsningsbarriere, inklusive en superledende kvanteinterferensanordning og magnetisk resonanskraftmikroskopi. Alligevel, disse rapporter kræver et kryogent miljø og højt vakuum til billeddannelse, begrænser den eksperimentelle implementering og dens oversættelse til klinisk praksis.
En nyligt udviklet kvanteregistreringsmetode baseret på kvælstofindsatscentret i diamant har radikalt rykket grænsen for MI-teknikker på nanoskala for at detektere organiske molekyler og proteiner i laboratoriet. Forskere har kombineret kvantesansning med NV-centre og scanningprobemikroskopi for at demonstrere nanoskala MRI for enkelt elektronspin og lille nuklear spin-ensemble, mens de bruger NV-centret som et biokompatibelt magnetometer til ikke-invasivt at afbilde ferromagnetiske partikler i celler i subcellulær skala (0,4 µm). For eksempel, depolarisering af NV-centret kan bruges som et bredbåndsmagnetometer til at detektere og måle fluktuerende støj fra metalioner og nukleare spins. Imidlertid, sådan billeddannelse af enkelte proteiner via MI på nanoskala er hidtil ikke blevet rapporteret i enkeltcellen.
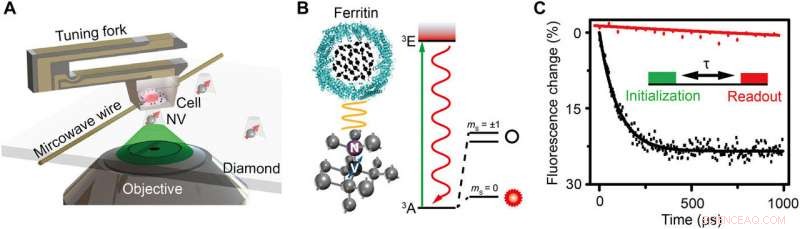
Skematisk over opsætning og forsøgsprincip. (A) Skematisk visning af den eksperimentelle opsætning. Cellen indlejret i harpiks er fastgjort til en stemmegaffel og scanner over diamantnanopillen, der indeholder et lavvandet NV-center. En kobbertråd bruges til at levere mikrobølgeimpulsen til NV-centret. En grøn laser (532 nm) fra det konfokale mikroskop (CFM) bruges til at adressere, initialisere, og læs NV-centret op. (B) Venstre:Krystalgitter og energiniveau for NV-centret. NV-centret er en punktdefekt, der består af et substitutionsnitrogenatom og en tilstødende ledig plads i diamant. Til højre:Skematisk billede af en ferritin. De sorte pile angiver elektronspin af Fe3+. (C) Eksperimentel demonstration af spinstøjdetektion med og uden ferritin i form af polarisationshenfald for samme NV-center. Indsatsen er pulssekvensen til påvisning og billeddannelse af ferritinet. En 5-μs grøn laser bruges til at initialisere spin-tilstanden til ms =0, efterfulgt af en fri udviklingstid τ for at akkumulere den magnetiske støj, og til sidst udlæses spin-tilstanden ved at detektere fluorescensintensiteten. Pulssekvensen gentages ca. 105 gange for at opnå et godt signal-til-støj-forhold (SNR). Relaksationstiden er tilpasset til at være 0,1 og 3,3 ms ved eksponentielt henfald for tilfældet med og uden ferritin, henholdsvis, hvilket indikerer en spinstøj på 0,01 mT2. Kredit:Science Advances, doi:10.1126/sciadv.aau8038.
I nærværende arbejde, Wang et al. rapporterede to tekniske fremskridt for at tillade MI af intracellulære proteiner i nanoskala i en enkelt celle. For det, de frysefikserede cellen til en fast tilstand og segmenterede den indviklet til en terningform, placerede den derefter på en stemmegaffel-scanningssonde i et atomkraftmikroskop (AFM) til billeddannelse, hvor det flade tværsnit af cellen var udsat for luft. Forskerne brugte prøveplaceringsopsætningen til at tillade NV-sensoren at blive placeret inden for 10 nm fra målproteinerne og brugte AFM til at undertrykke termisk drift under prøvepositionering. De konstruerede derefter trapezformede cylinderformede nanopiller ved en bulk diamantoverflade til billedoptagelse, teknisk forkortelse af billedoptagelsestiden med én ordre sammenlignet med tidligere metoder. I nærværende undersøgelse, forskerne brugte denne teknik til at udføre in situ MI af den magnetiske fluktuerende støj fra intracellulære ferritinproteiner (en biomarkør for jernlagre og transferrinmætning i kroppen) inden for forsøgsopstillingen.
Ferritin er et kugleformet proteinkompleks med en ydre diameter på 12 nm, indeholdende et hulrum, der spænder over 8 nm i diameter, der gør det muligt at lagre op til 4500 jernatomer i proteinet. Den magnetiske støj fra jern-ionerne kan detekteres på grund af deres virkninger på T 1 afslapningstid af et NV-center. I dette arbejde, Wang et al. bekræftede observationen ved hjælp af fluorescensmålinger af tidsafhængigt henfald af populationen af NV-centre (magnetisk spin, m S =0 tilstand), i en diamantoverflade belagt med ferritiner. Derudover forskerne opdagede den magnetiske støj med etiketfri metoder ved hjælp af NV-centret via transmissionselektronmikroskopi (TEM). Arbejdet tillod udviklingen af et korreleret MI- og TEM-skema for at opnå og verificere den første nanoskala MI af et protein in situ.
Forskerne brugte leverkarcinomcellelinjen (HepG2) til eksperimenterne og studerede jernmetabolisme ved at behandle cellerne med ferriammoniumcitrat (FAC), hvilket øgede mængden af intracellulært ferritin markant. De bekræftede dette ved hjælp af konfokal mikroskopi (CFM), western blotting og TEM-teknikker i starten. Resultaterne viste den primære lokalisering af ferritiner i den intracellulære puncta omkring kernen, blandt cytoplasmaet. The scientists used bulk electron paramagnetic resonance (EPR) spectroscopy to confirm the paramagnetic properties of ferritin in the FAC-treated HepG2 cells and mass spectroscopy to measure the interference due to other paramagnetic metal ions.
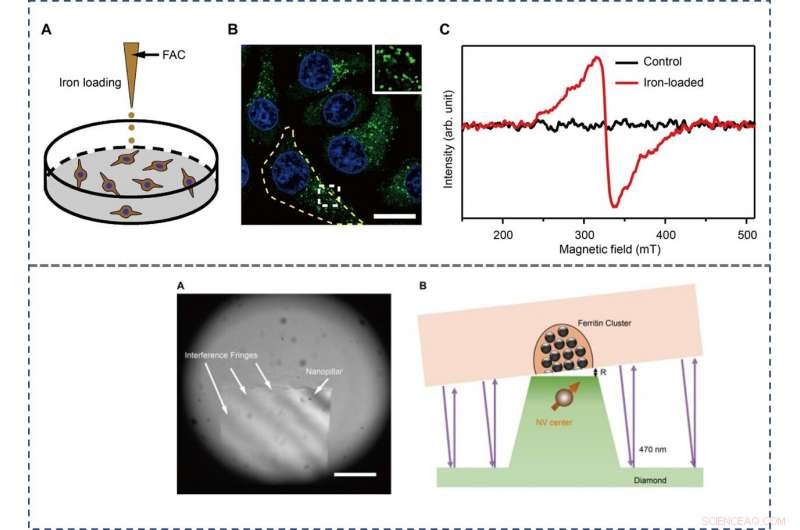
TOP - The preparation and characterization of ferritin-rich HepG2 cell samples. (A) Schematic view of the treatment to cultured cells. Following iron loading or no treatment, the HepG2 cells were examined for fluorescence images and EPR spectra, henholdsvis. For the MI and TEM imaging, cell samples were treated through high-pressure freezing, freeze substitution, and sectioning. (B) Representative confocal microscopy (CFM) image of ferritin structures (green) in iron-loaded HepG2 cells. The ferritin proteins were immunostained by anti-ferritin light chain antibody. The nuclei are indicated by 4′, 6-diamidino-2-phenylindole (DAPI) in the blue channel. Inset displays magnified ferritin structures. The yellow dashed line outlines the contour of a cell. Målestok, 20 μm. (C) EPR spectra of control and iron-loaded HepG2 cells at T =300 K. BOTTOM - Adjusting the distance between the NV center and the cell section. (A) Interference fringes between the cell cube and the diamond surface. Målestok, 20 μm. (B) The geometric relation and the gap R between cell samples and diamond-pillars for MI. The top surface diameter of the nanopillar is 400 nm. Kredit:Science Advances, doi:10.1126/sciadv.aau8038.
Wang et al. then used ultrafast, high-pressure freezing to immobilize all intracellular components of the Fe-loaded cells. The process stabilized the intracellular structures and molecules by minimizing Brownian motion in cells, which typically contributes to random motion of proteins up to 100 nm in vivo. To image the samples, they embedded and polymerized the frozen cells in LR White medium, followed by gluing the embedded cell sample to the AFM tuning fork with a few cells at the tip. Using a diamond knife, the scientists then sectioned the tip surface to nanometer flatness to examine the cuboid cell section under AFM. They acquired MI images of ferritins by scanning the cell cube along the diamond nanopillars and simultaneously measured NV spin repolarization rate using the "leapfrog" scanning mode of the microscope as detailed previously.
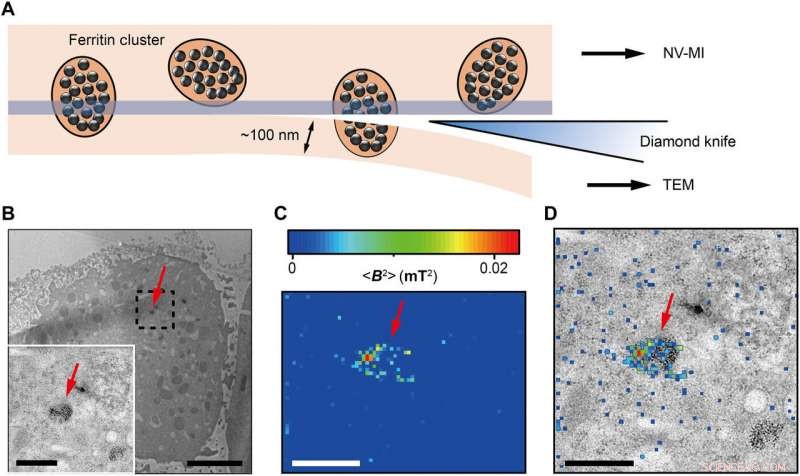
Correlative MI and TEM images. (A) Schematic view of sectioning for correlative MI and TEM imaging. The last section and the remaining cube were transferred for TEM imaging and MI scanning, henholdsvis. The sectioning resulted in some split ferritin clusters that could be imaged under both microscopes. A transparent blue strip of ~10 nm indicates the imaging depth of the MI, while in the TEM, the imaging depth is ~100 nm. (B) Distribution of ferritins from the last ultrathin section under TEM. Inset:Magnified figure of the part in black dashed box. (C) MI result of the remaining cell cube. The pixel size is 43 nm. (D) The merged MI and TEM micrograph shows ferritins in a membrane-bound organelle. The red arrows in (B) to (D) indicate the same ferritin cluster. Skala barer, 5 μm (B) and 1 μm [B (inset), C, and D]. Kredit:Science Advances, doi:10.1126/sciadv.aau8038.
The scientists measured fluorescence decay at a fixed free evolution time of 50 microseconds (τ =50 μs) to reveal the degree of NV sensor spin polarization, which correlated with the amount of ferritin in the sensing volume. They observed the appearance of some clusters via both TEM and MI images, although some details were not observed in MI, the results confirmed that spin noise from intracellular ferritin contributed to depolarize the NV center. In order to obtain details of the ferritin clusters at higher resolution, the scientists minimized the pixel size to 8.3 nm and acquired MI of high resolution of the proteins as expected.
På denne måde Wang et al. explored the sensitivity of NV centers as an appropriate sensor for biological imaging applications at the level of the single molecule. They used the technique as a sensor in the experimental setup to obtain the first MI of a protein at a resolution of 10 nm in situ. The scientists aim to improve the stability and sensitivity of the technique to speed up the scanning process and image a larger area of interest in the cell and locate ferritin beyond the nucleus in association with additional organelles.
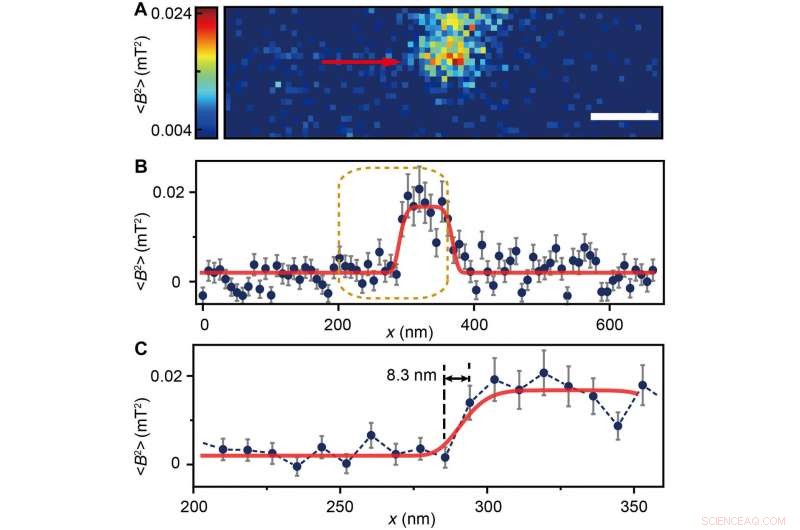
(A) Ferritin cluster imaged by the NV sensor with 80 × 24 pixels and a pixel size of 8.3 nm. Målestok, 100 nm. (B) Trace data of the scanning line in (A) directed by the red arrow. The platform indicates the ferritin cluster. The red curve fitted by a plateau function serves as a guide to the eye. (C) Magnified figure of the gold dashed box in (B). The sharp transition indicated by the red arrow around x =283 nm shows the scanning from the blank area to the area with ferritins. Kredit:Science Advances, doi:10.1126/sciadv.aau8038.
The work will contribute to clinical diagnostics to determine biomarker-based iron storage and release in cells. This will include studies on the regulatory mechanisms of iron metabolism during the progression of hemochromatosis, anæmi, liver cirrhosis and Alzheimer's disease. Wang et al. propose to extend the approach in situ to other cellular components with paramagnetic signals, including magnetic molecules, metalloproteins and special spin-labelled proteins. The scientists envision that further studies will explore additional targets suitable for high-resolution MI and correlated TEM imaging techniques, with optical microscopy detection incorporated to the experimental setup to extend the work and determine protein nuclear spin MRI as well as perform three-dimensional cell tomography.
© 2019 Science X Network
 Varme artikler
Varme artikler
-
 Ingeniører udvikler chip, der omdanner spildvarme til brugbar energiUniversity of Utah maskinteknik lektor Mathieu Francoeur har opdaget en måde at producere mere elektricitet fra varme end antaget muligt ved at skabe en siliciumchip, også kendt som en enhed, , der om
Ingeniører udvikler chip, der omdanner spildvarme til brugbar energiUniversity of Utah maskinteknik lektor Mathieu Francoeur har opdaget en måde at producere mere elektricitet fra varme end antaget muligt ved at skabe en siliciumchip, også kendt som en enhed, , der om -
 Forskere anvender grafenmagisk vinkel i nanoskala til akustikEn visualisering af det akustiske grafenarray. Kredit:Yun Jing To atomare tynde carbonplader stablet oven på hinanden, kaldet tolagsgrafen, udviser unikke egenskaber, når et af lagene er snoet i e
Forskere anvender grafenmagisk vinkel i nanoskala til akustikEn visualisering af det akustiske grafenarray. Kredit:Yun Jing To atomare tynde carbonplader stablet oven på hinanden, kaldet tolagsgrafen, udviser unikke egenskaber, når et af lagene er snoet i e -
 Nanopartikler udviklet til at forbedre magnetiske resonansscanningsbillederKredit:Asociación RUVID Forskere ved Chemical Technology Institute (ITQ) i Unviersitat Politècnica de València og samarbejdende institutioner har udviklet nanopartikler, der forbedrer kontrasten i
Nanopartikler udviklet til at forbedre magnetiske resonansscanningsbillederKredit:Asociación RUVID Forskere ved Chemical Technology Institute (ITQ) i Unviersitat Politècnica de València og samarbejdende institutioner har udviklet nanopartikler, der forbedrer kontrasten i -
 Bygget til hastighed:DNA-nanomaskiner tager et (hurtigt) skridt fremadGennem en proces kendt som strengforskydning, en lillebitte gåanordning, der består af DNA, bevæger sig hen over en overflade i en rullende bevægelse. Den nye enhed udførte denne bedrift hurtigere end
Bygget til hastighed:DNA-nanomaskiner tager et (hurtigt) skridt fremadGennem en proces kendt som strengforskydning, en lillebitte gåanordning, der består af DNA, bevæger sig hen over en overflade i en rullende bevægelse. Den nye enhed udførte denne bedrift hurtigere end
- 3-D røntgentomografi samler oplysninger op om ismikrostruktur
- Det overraskende omfang af Kinas rumprogram
- Undersøgelse finder mulige fordele ved sameksistens mellem dyreliv og husdyr i Østafrika
- Vulkan under iskappe tyder på, at fortykkelse af vestantarktisk is er kortsigtet
- Sådan skaber du smart city-teknologi med tilsluttede biler
- Cellevæg: Definition, struktur og funktion (med diagram)


