Nye nanopartikler leverer CRISPR-genredigeringsværktøjer ind i cellen med meget højere effektivitet
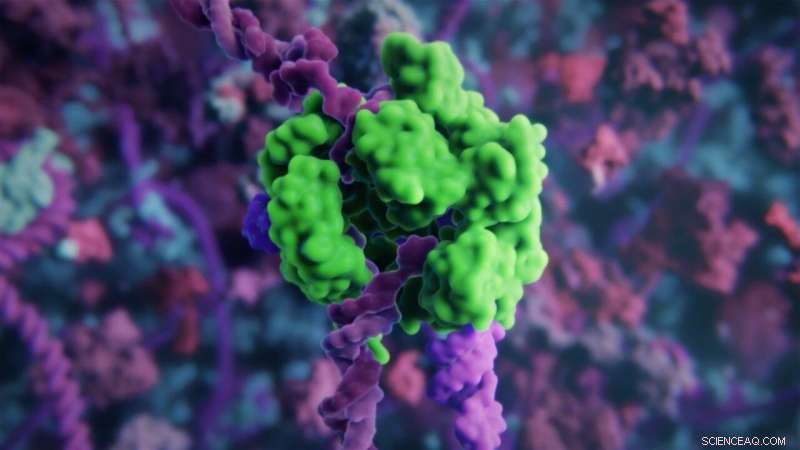
Det store kompleks af genredigeringsmolekyler er vanskeligt at levere til celler fra eksternt og eksternt program. Bionedbrydelige lipid -nanopartikler leverer mRNA -kodning for genredigeringsmolekylerne ind i cellen Kredit:Fra animation af Visual Science og Skoltech, visual-science.com/crispr
Et forskningssamarbejde mellem Tufts University og det kinesiske videnskabsakademi har ført til udviklingen af en betydeligt forbedret leveringsmekanisme for CRISPR/Cas9 genredigeringsmetoden i leveren, ifølge en undersøgelse, der for nylig blev offentliggjort i tidsskriftet Avancerede materialer . Leveringen bruger biologisk nedbrydelige syntetiske lipid-nanopartikler, der bærer de molekylære redigeringsværktøjer ind i cellen for præcist at ændre cellernes genetiske kode med så meget som 90 procent effektivitet. Nanopartiklerne repræsenterer et af de mest effektive CRISPR/Cas9 leveringsværktøjer, der hidtil er rapporteret, ifølge forskerne, og kunne hjælpe med at overvinde tekniske forhindringer for at muliggøre genredigering i en bred vifte af kliniske terapeutiske anvendelser.
CRISPR/Cas9-genredigeringssystemet er blevet et kraftfuldt forskningsværktøj, der afslører funktionen af hundredvis af gener og er i øjeblikket ved at blive udforsket som et terapeutisk værktøj til behandling af forskellige sygdomme. Imidlertid, nogle tekniske forhindringer tilbage, før det kan være praktisk til kliniske anvendelser. CRISPR/Cas9 er et stort molekylært kompleks, indeholdende både en nuklease (Cas9), der kan skære gennem begge strenge af en målrettet genomisk sekvens, og et konstrueret 'single-guide' RNA (sgRNA), der scanner genomet for at hjælpe nukleasen med at finde den specifikke sekvens, der skal redigeres. Da det er et stort molekylært kompleks, det er svært at levere CRISPR/Cas9 direkte ind i cellens kerne, hvor den kan gøre sit arbejde. Andre har pakket redigeringsmolekylerne ind i vira, polymerer, og forskellige typer nanopartikler for at få dem ind i kernen, men den lave effektivitet af overførsel har begrænset deres anvendelse og styrke til kliniske anvendelser.
Lipid-nanopartiklerne beskrevet i undersøgelsen indkapsler messenger-RNA (mRNA), der koder for Cas9. Når indholdet af nanopartiklerne - inklusive sgRNA - er frigivet til cellen. Cellens proteinfremstillingsmaskineri tager over og skaber Cas9 fra mRNA-skabelonen, færdiggørelse af genredigeringssættet. Et unikt træk ved nanopartiklerne er fremstillet af syntetiske lipider omfattende disulfidbindinger i fedtkæden. Når partiklerne kommer ind i cellen, miljøet i cellen bryder disulfidbindingen op for at skille nanopartiklerne ad, og indholdet frigives hurtigt og effektivt ind i cellen.
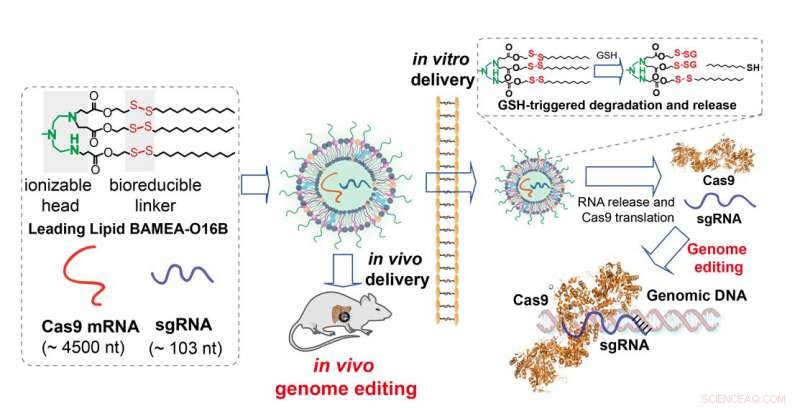
Lipider formuleret med en bioreducerbar linker danner væggen af nanopartikler, der indkapsler mRNA'et fra Cas9 plus sgRNA. Da vi kom ind i cellen, in vitro eller in vivo, linkerne brydes, og partiklerne desintegrerer til levering af indhold og translation af mRNA til aktivt enzym til CRISPR/Cas9 genomredigering Kredit:Qiaobing Xu, Tufts Universitet
"Vi er lige begyndt at se kliniske forsøg med mennesker for CRISPR-terapier, " sagde Qiaobing Xu, medkorresponderende forfatter til undersøgelsen og lektor i biomedicinsk teknik ved Tufts University. "Der er mange sygdomme, som længe har været vanskelige at behandle, som CRISPR-terapier kunne give nyt håb for - for eksempel seglcellesygdom, Duchenne muskeldystrofi, Huntingtons sygdom, og endda mange kræftformer. Vores håb er, at dette fremskridt vil tage os endnu et skridt i retning af at gøre CRISPR til en effektiv og praktisk tilgang til behandling."
Forskerne anvendte den nye metode til mus, forsøger at reducere tilstedeværelsen af et gen, der koder for PCSK9, hvis tab er forbundet med lavere LDL-kolesterol, og reduceret risiko for hjerte -kar -sygdomme. "Lipid -nanopartiklerne er en af de mest effektive CRISPR/Cas9 -bærere, vi har set, " sagde Ming Wang, også medkorresponderende forfatter til undersøgelsen og professor ved det kinesiske videnskabsakademi, Beijing National Laboratory for Molecular Science. "Vi kan faktisk slå PCSK9-ekspression ned i mus med 80 procent effektivitet i leveren, tyder på et reelt løfte om terapeutiske anvendelser. "
 Varme artikler
Varme artikler
-
 Cell-tracking-agenter får et løftEn forbedret forbindelse af vismut og carbon nanorør kaldet Bi4C@US-rør, udviklet på Rice University, CHI St. Lukes Health-Baylor St. Lukes Medical Center og Baylor College of Medicine, kunne forbedre
Cell-tracking-agenter får et løftEn forbedret forbindelse af vismut og carbon nanorør kaldet Bi4C@US-rør, udviklet på Rice University, CHI St. Lukes Health-Baylor St. Lukes Medical Center og Baylor College of Medicine, kunne forbedre -
 Små pakker kan indeholde kraftfuld behandling af hjernetumorerDr. Ann-Marie Broome, ret, kan lide at samarbejde med Dr. Amy Lee Bredlau, venstre, der bringer et klinisk perspektiv til laboratoriet. Kredit:Sarah Pack Store opdagelser kommer i små pakker. Få v
Små pakker kan indeholde kraftfuld behandling af hjernetumorerDr. Ann-Marie Broome, ret, kan lide at samarbejde med Dr. Amy Lee Bredlau, venstre, der bringer et klinisk perspektiv til laboratoriet. Kredit:Sarah Pack Store opdagelser kommer i små pakker. Få v -
 Gammel effekt udnyttet til at producere elektricitet fra spildvarmeEt fænomen først observeret af en gammel græsk filosof 2, For 300 år siden er blevet grundlaget for en ny enhed designet til at høste de enorme mængder energi, der spildes som varme hvert år for at pr
Gammel effekt udnyttet til at producere elektricitet fra spildvarmeEt fænomen først observeret af en gammel græsk filosof 2, For 300 år siden er blevet grundlaget for en ny enhed designet til at høste de enorme mængder energi, der spildes som varme hvert år for at pr -
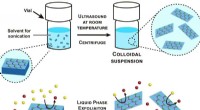 Kolloide dispersioner af nanoark til katalyseDiagram over eksfolieringsprocessen i flydende fase. Kredit:ICN2 Forskere fra ICN2 Nanostructured Functional Materials Group, i samarbejde med andre institutioner, har brugt en flydende fase eksfo
Kolloide dispersioner af nanoark til katalyseDiagram over eksfolieringsprocessen i flydende fase. Kredit:ICN2 Forskere fra ICN2 Nanostructured Functional Materials Group, i samarbejde med andre institutioner, har brugt en flydende fase eksfo
- Nye satellitbilleder afslører det nye højeste antarktiske halvø-bjerg
- En ikke-destruktiv metode til at analysere oldægyptiske balsameringsmaterialer
- CT-scanning af et gammelt pansret krybdyr
- Berømt sandbunkemodel vist at bevæge sig som en omrejsende klit
- Biokemikere rapporterer en måde at stoppe kræftcellernes udødelighed med oligonukleotider
- Næringsstofgenbrugsmikrober kan føle varmen


