Forskere bruger lipid-nanopartikler til præcist at målrette genredigering til leveren
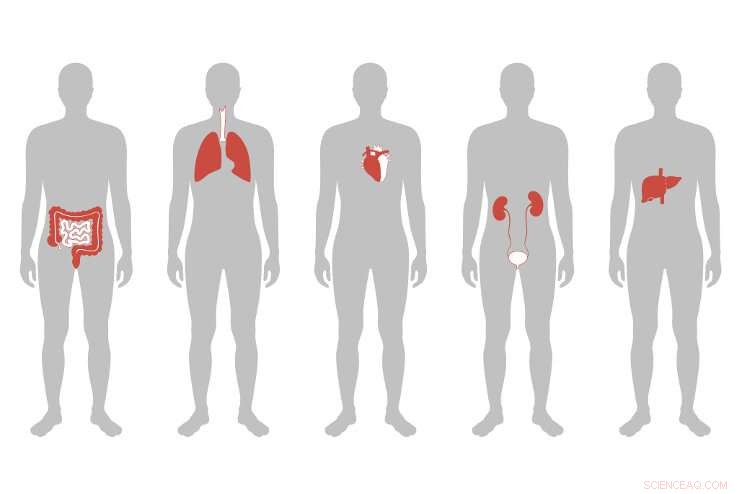
Forskere udviklede nanopartikler, der bærer en genredigeringspakke specifikt til leveren hos mus, med succes at reducere niveauet af LDL "dårligt" kolesterol i blodet. Sammen med tidligere undersøgelser, der viser levering til hjernen eller T-celler, antyder en fremtidig mulighed for meget målrettede genredigeringsterapier. Kredit:Tufts University
Genomredigeringsteknologien CRISPR er dukket op som et kraftfuldt nyt værktøj, der kan ændre den måde, vi behandler sygdom på. Udfordringen ved at ændre genetikken i vores celler, imidlertid, er hvordan man gør det sikkert, effektivt, og specifikt målrettet mod genet, væv og organ, der skal behandles. Forskere ved Tufts University og Broad Institute of Harvard og MIT har udviklet unikke nanopartikler bestående af lipider - fedtmolekyler - der kan pakke og levere genredigeringsmaskineri specifikt til leveren. I en undersøgelse offentliggjort i dag i Proceedings of the National Academy of Sciences , de har vist, at de kan bruge lipid-nanopartiklerne (LNP'er) til effektivt at levere CRISPR-maskineriet ind i leveren på mus, resulterer i specifik genomredigering og reduktion af kolesterolniveauet i blodet med så meget som 57 % - en reduktion, der kan vare i mindst flere måneder med kun et enkelt skud.
Problemet med forhøjet kolesterol plager mere end 29 millioner amerikanere, ifølge Centers for Disease Control and Prevention. Tilstanden er kompleks og kan stamme fra flere gener samt ernærings- og livsstilsvalg, så det er ikke nemt at behandle. Tufts og Broad-forskerne, imidlertid, har modificeret ét gen, der kunne give en beskyttende effekt mod forhøjet kolesterol, hvis det kan lukkes ned ved genredigering.
Genet, som forskerne fokuserede på, koder for det angiopoietin-lignende 3-enzym (Angptl3). Det enzym dæmper aktiviteten af andre enzymer - lipaser - der hjælper med at nedbryde kolesterol. Hvis forskere kan slå Angptl3-genet ud, de kan lade lipaserne gøre deres arbejde og reducere niveauet af kolesterol i blodet. Det viser sig, at nogle heldige mennesker har en naturlig mutation i deres Angptl3-gen, fører til konsekvent lave niveauer af triglycerider og low-density lipoprotein (LDL) kolesterol, almindeligvis kaldet "dårligt" kolesterol, i deres blodbane uden kendte kliniske ulemper.
"Hvis vi kan replikere den tilstand ved at slå angptl3-genet ud i andre, vi har en god chance for at have en sikker og langsigtet løsning på forhøjet kolesterol, " sagde Qiaobing Xu, lektor i biomedicinsk teknik ved Tufts' Ingeniørskole og tilsvarende forfatter til undersøgelsen. "Vi skal bare sørge for, at vi leverer genredigeringspakken specifikt til leveren for ikke at skabe uønskede bivirkninger."
Xus team var i stand til at gøre netop det i musemodeller. Efter en enkelt injektion af lipid-nanopartikler pakket med mRNA, der koder for CRISPR-Cas9 og et enkelt-guide RNA målrettet Angptl3, de observerede en markant reduktion i LDL-kolesterol med så meget som 57 % og triglyceridniveauer med omkring 29 %, som begge forblev på de sænkede niveauer i mindst 100 dage. Forskerne spekulerer i, at effekten kan vare meget længere end det, måske kun begrænset af den langsomme omsætning af celler i leveren, hvilket kan ske over en periode på omkring et år. Reduktionen af kolesterol og triglycerider er dosisafhængig, så deres niveauer kunne justeres ved at injicere færre eller flere LNP'er i det enkelte skud, sagde forskerne.
Til sammenligning, en eksisterende, FDA-godkendt version af CRISPR mRNA-ladede LNP'er kunne kun reducere LDL-kolesterol med højst 15,7% og triglycerider med 16,3%, når det blev testet i mus, ifølge forskerne.
Tricket til at lave en bedre LNP var at tilpasse komponenterne - de molekyler, der samles for at danne bobler omkring mRNA'et. LNP'erne består af langkædede lipider, der har et ladet eller polært hoved, der tiltrækkes af vand, en kulstofkædehale, der peger mod midten af boblen, der indeholder nyttelasten, og en kemisk linker mellem dem. Også til stede er polyethylenglycol, og ja, selv noget kolesterol - som har en normal rolle i lipidmembraner for at gøre dem mindre utætte - for at holde deres indhold bedre.
Forskerne fandt ud af, at arten og det relative forhold mellem disse komponenter så ud til at have dybtgående virkninger på leveringen af mRNA til leveren, så de testede LNP'er med mange kombinationer af hoveder, haler, linkere og forhold mellem alle komponenter for deres evne til at målrette leverceller. Fordi in vitro-styrken af en LNP-formulering sjældent afspejler dens in vivo-ydelse, de evaluerede direkte leveringsspecificiteten og effektiviteten hos mus, der har et reportergen i deres celler, der lyser rødt, når genomredigering finder sted. Ultimativt, de fandt en CRISPR mRNA-ladet LNP, der kun oplyste leveren hos mus, viser, at det specifikt og effektivt kunne levere genredigeringsværktøjer ind i leveren for at udføre deres arbejde.
LNP'erne blev bygget på tidligere arbejde på Tufts, hvor Xu og hans team udviklede LNP'er med så meget som 90% effektivitet til at levere mRNA til celler. Et unikt træk ved disse nanopartikler var tilstedeværelsen af disulfidbindinger mellem de lange lipidkæder. Uden for cellerne, LNP'erne danner en stabil sfærisk struktur, der låser deres indhold fast. Når de er inde i en celle, miljøet indeni bryder disulfidbindingerne for at skille nanopartiklerne ad. Indholdet frigives derefter hurtigt og effektivt ind i cellen. Ved at forhindre tab uden for cellen, LNP'erne kan have et meget højere udbytte ved at levere deres indhold.
"CRISPR er et af de mest kraftfulde terapeutiske værktøjer til behandling af sygdomme med en genetisk ætiologi. Vi har for nylig set det første humane kliniske spor for CRISPR-terapi muliggjort af LNP-levering til at blive administreret systemisk for at redigere gener inde i den menneskelige krop. Vores LNP platform udviklet her rummer et stort potentiale for klinisk oversættelse, " sagde Min Qiu, post-doc forsker i Xus laboratorium på Tufts. "Vi forestiller os, at med denne LNP-platform i hånden, vi kunne nu gøre CRISPR til en praktisk og sikker tilgang til behandling af et bredt spektrum af leversygdomme eller lidelser, " sagde Zachary Glass, kandidatstuderende i Xu-laboratoriet. Qiu og Glass er co-first forfattere af undersøgelsen.
 Varme artikler
Varme artikler
-
 Kinesisk team udvikler hudlignende triboelektrisk nanogeneratorEn gennemsigtig elektronisk hud til taktil sansning. Kredit:Xiong Pu (Phys.org) – Et team af forskere med National Center for Nanoscience and Technology i Kina har udviklet, hvad det kalder en hud
Kinesisk team udvikler hudlignende triboelektrisk nanogeneratorEn gennemsigtig elektronisk hud til taktil sansning. Kredit:Xiong Pu (Phys.org) – Et team af forskere med National Center for Nanoscience and Technology i Kina har udviklet, hvad det kalder en hud -
 Plasma-ioniseringsbaserede 3-D titania nanofiberlignende baner til forbedring af biomaterialers bior…Skematiske mekanismer for celleproliferation og osteoinduktivitet af nanofibert titaniumcoating ved overflademodifikation gennem højintensitets laserinduceret reverse transfer (HILIRT):En ny deponerin
Plasma-ioniseringsbaserede 3-D titania nanofiberlignende baner til forbedring af biomaterialers bior…Skematiske mekanismer for celleproliferation og osteoinduktivitet af nanofibert titaniumcoating ved overflademodifikation gennem højintensitets laserinduceret reverse transfer (HILIRT):En ny deponerin -
 Udvikling af en 3-D kollagenmodel til at teste magnetisk assisteret osteogenese in vitroa) Mikrostruktur af cellefyldte kollagen stilladser undersøgt under TEM. Celler er omgivet af kollagenmatrixen. Kollagenfibrillerne viste ingen foretrukken retning omkring cellerne under kontrolforhol
Udvikling af en 3-D kollagenmodel til at teste magnetisk assisteret osteogenese in vitroa) Mikrostruktur af cellefyldte kollagen stilladser undersøgt under TEM. Celler er omgivet af kollagenmatrixen. Kollagenfibrillerne viste ingen foretrukken retning omkring cellerne under kontrolforhol -
 Nanoantenne koncentrerer lyset:Intensiteten øges 1, 000 gangeDenne kunstners gengivelse viser, hvordan plasmoner i et par guld nanospidser koncentrerer lyset fra en laser, forstærker det med en faktor på 1, 000. Kredit:Natelson Lab/Rice University (PhysOrg.
Nanoantenne koncentrerer lyset:Intensiteten øges 1, 000 gangeDenne kunstners gengivelse viser, hvordan plasmoner i et par guld nanospidser koncentrerer lyset fra en laser, forstærker det med en faktor på 1, 000. Kredit:Natelson Lab/Rice University (PhysOrg.
- Hubble viser en bemærkelsesværdig galaktisk hybrid
- Naturbrande kan forårsage farlige affaldsstrømme
- Top 5 energieffektive computerskærme
- Laserskrivning muliggør praktisk flad optik og datalagring i glas
- Fysikere dyrker mikromaskiner fra kulstof
- Stop med at bekymre dig om, hvor meget energi bitcoin bruger


