Småmolekyleterapi:Big data-drømme for små teknologier
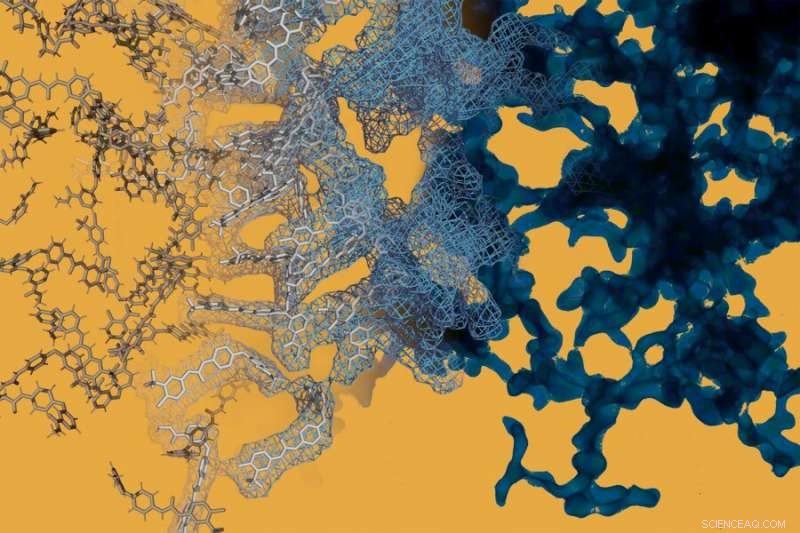
En simulering af molekylær dynamik (til venstre) er sidestillet med et elektronmikroskopibillede (til højre) af kræftlægemidlet sorafenib. Sorafenib, ligesom mange andre små molekyle lægemidler, kan spontant danne indviklede strukturer i nanoskala, der ændrer, hvordan stoffet opfører sig. Kredit:Daniel Reker
Små molekyler behandler en lang række sygdomme, men deres effektivitet er ofte formindsket på grund af deres farmakokinetik - hvad kroppen gør ved et lægemiddel. Efter administration, kroppen dikterer, hvor meget af lægemidlet der absorberes, hvilke organer stoffet kommer ind i, og hvor hurtigt kroppen omsætter og udskiller stoffet igen.
Nanopartikler, normalt lavet af lipider, polymerer, eller begge, kan forbedre farmakokinetikken, men de kan være komplekse at fremstille og bærer ofte meget lidt af stoffet.
Nogle kombinationer af små molekyle kræftlægemidler og to små molekyle farvestoffer har vist sig at samle sig selv til nanopartikler med ekstremt høj nyttelast af lægemidler, men det er svært at forudsige, hvilke partnere med små molekyler, der vil danne nanopartikler blandt de millioner af mulige parringer.
MIT-forskere har udviklet en screeningsplatform, der kombinerer maskinlæring med high-throughput eksperimentering for hurtigt at identificere selvsamlende nanopartikler. I en undersøgelse offentliggjort i Natur nanoteknologi , forskere screenede 2,1 millioner parringer af småmolekylære lægemidler og "inaktive" lægemiddelingredienser, identifikation af 100 nye nanopartikler med potentielle anvendelser, der omfatter behandling af kræft, astma, malaria, og virus- og svampeinfektioner.
"Vi har tidligere beskrevet nogle af de negative og positive virkninger, som inaktive ingredienser kan have på lægemidler, og her, gennem et samordnet samarbejde på tværs af vores laboratorier og kernefaciliteter, beskrive en tilgang med fokus på de potentielle positive effekter, disse kan have på nanoformulering, " siger Giovanni Traverso, Karl Van Tassel (1925) Karriereudviklingsprofessor i maskinteknik, og senior korresponderende forfatter af undersøgelsen.
Deres resultater peger på en strategi for, der løser både kompleksiteten ved at producere nanopartikler og vanskeligheden ved at fylde store mængder medicin på dem.
"Så mange stoffer derude lever ikke op til deres fulde potentiale på grund af utilstrækkelig målretning, lav biotilgængelighed, eller hurtig stofskifte, " siger Daniel Reker, hovedforfatter af undersøgelsen og en tidligere postdoc i laboratoriet hos Robert Langer. "Ved at arbejde på datavidenskabens grænseflade, maskinelæring, og medicinafgivelse, vores håb er hurtigt at udvide vores værktøjssæt til at sikre, at et lægemiddel kommer til det sted, det skal være og rent faktisk kan behandle og hjælpe et menneske."
Langer, David H. Koch Institute Professor ved MIT og medlem af Koch Institute for Integrative Cancer Research, er også seniorforfatter af papiret.
En kræftbehandling møder sit match
For at udvikle en maskinlæringsalgoritme, der er i stand til at identificere selvsamlende nanopartikler, forskerne skulle først bygge et datasæt, som algoritmen kunne træne på. De udvalgte 16 selvaggregerende småmolekylære lægemidler med en række kemiske strukturer og terapeutiske anvendelser og et forskelligartet sæt af 90 bredt tilgængelige forbindelser, inklusive ingredienser, der allerede er tilsat stoffer for at få dem til at smage bedre, hold længere, eller gøre dem mere stabile. Fordi både lægemidlerne og de inaktive ingredienser allerede er FDA-godkendte, de resulterende nanopartikler er sandsynligvis sikrere og bevæger sig hurtigere gennem FDA-godkendelsesprocessen.
Holdet testede derefter hver kombination af småmolekylelægemiddel og inaktiv ingrediens, aktiveret af Swanson Biotechnology Center, en suite af kernefaciliteter, der leverer avancerede tekniske tjenester inden for Koch Institute. Efter blanding af parringer og indlæsning af 384 prøver ad gangen på nanobrøndplader ved hjælp af robotteknologi i High Throughput Sciences-kernen, forskere gik på pladerne, ofte med hurtigt nedbrydende prøver, ved siden af Peterson (1957) Nanotechnology Materials Core Facility-kernen til at måle størrelsen af partikler med høj gennemløbsdynamisk lysspredning.
Nu trænet den 1. 440 datapunkter (med 94 nanopartikler allerede identificeret), maskinlæringsplatformen kunne slås på et meget større bibliotek af forbindelser. Screening af 788 småmolekylære lægemidler mod mere end 2, 600 inaktive lægemiddelingredienser, platformen identificerede 38, 464 potentielle selvsamlende nanopartikler fra 2,1 millioner mulige kombinationer.
Forskerne udvalgte seks nanopartikler til yderligere validering, inklusive en sammensat af sorafenib, en behandling, der almindeligvis anvendes til fremskreden lever- og andre kræftformer, og glycyrrhizin, en forbindelse, der ofte bruges som både fødevare- og lægemiddeltilsætningsstof og mest kendt som lakridsaroma. Selvom sorafenib er standarden for behandling af fremskreden leverkræft, dens effektivitet er begrænset.
I humane leverkræftcellekulturer, sorafenib-glycyrrhizin nanopartiklerne virkede dobbelt så godt som sorafenib i sig selv, fordi mere af stoffet kunne trænge ind i cellerne. Arbejde med den prækliniske modellering, Billed- og testfacilitet på Koch Institute, forskere behandlede musemodeller af leverkræft for at sammenligne virkningerne af sorafenib-glycyrrhizin-nanopartikler i forhold til begge forbindelser i sig selv. De fandt, at nanopartiklerne signifikant reducerede niveauet af en markør forbundet med leverkræftprogression sammenlignet med mus, der fik sorafenib alene, og levede længere end mus, der fik sorafenib eller glycyrrhizin alene. Sorafenib-glycyrrhizin nanopartiklerne viste også forbedret målretning mod leveren sammenlignet med oral administration af sorafenib, den nuværende standard i klinikken, eller når du injicerer sorafenib, efter at det er blevet kombineret med cremophor, et almindeligt anvendt lægemiddelvehikel, der forbedrer vandopløseligheden, men som har toksiske bivirkninger.
Personlig medicinlevering
Den nye platform kan have nyttige applikationer ud over at optimere effektiviteten af aktive lægemidler:den kan bruges til at tilpasse inaktive stoffer, så de passer til individuelle patienters behov. I tidligere arbejde, medlemmer af holdet fandt ud af, at inaktive ingredienser kunne fremkalde uønskede allergiske reaktioner hos nogle patienter. Nu, med den udvidede maskinlæringsværktøjskasse, der kunne genereres flere muligheder for at tilbyde alternativer til disse patienter.
"Vi har mulighed for at tænke på at tilpasse leveringssystemet til patienten, " forklarer Reker, nu assisterende professor i biomedicinsk teknik ved Duke University. "Vi kan redegøre for ting som lægemiddelabsorption, genetik, selv allergi for at reducere bivirkninger ved fødslen. Uanset mutationen eller den medicinske tilstand, det rigtige lægemiddel er kun det rigtige lægemiddel, hvis det rent faktisk virker for patienten."
Værktøjerne til sikker, der findes effektiv lægemiddellevering, men at sætte alle ingredienserne sammen kan være en langsom proces. Kombinationen af maskinlæring, hurtig screening, og evnen til at forudsige interaktioner mellem forskellige kombinationer af materialer vil fremskynde design af lægemidler og de nanopartikler, der bruges til at levere dem i hele kroppen.
I det løbende arbejde, holdet søger ikke kun at forbedre effektiv levering af lægemidler, men også efter muligheder for at skabe medicin til mennesker, for hvem standardformuleringer ikke er en god mulighed, bruge big data til at løse problemer i små populationer ved at se på genetisk historie, allergier, og madreaktioner.
Denne historie er genudgivet med tilladelse fra MIT News (web.mit.edu/newsoffice/), et populært websted, der dækker nyheder om MIT-forskning, innovation og undervisning.
 Varme artikler
Varme artikler
-
 Arrangementer og mobilitet af bløde nanopartikler i tætte suspensionerEt skema over bløde nanokolloide suspensioner bestående af blød polyethylenglycol (PEG) bundet silicananopartikler suspenderet i PEG-oligomerer. Billederne viser variationen i fysiske egenskaber med s
Arrangementer og mobilitet af bløde nanopartikler i tætte suspensionerEt skema over bløde nanokolloide suspensioner bestående af blød polyethylenglycol (PEG) bundet silicananopartikler suspenderet i PEG-oligomerer. Billederne viser variationen i fysiske egenskaber med s -
 Kræftbekæmpende nanorobotter programmeret til at søge og ødelægge tumorerThrombin kan blokere tumorens blodgennemstrømning ved at størkne blodet i de kar, der nærer tumorvækst, forårsager en slags tumor mini-hjerteanfald, og fører til tumorvævsdød. Kredit:Jason Drees, Ariz
Kræftbekæmpende nanorobotter programmeret til at søge og ødelægge tumorerThrombin kan blokere tumorens blodgennemstrømning ved at størkne blodet i de kar, der nærer tumorvækst, forårsager en slags tumor mini-hjerteanfald, og fører til tumorvævsdød. Kredit:Jason Drees, Ariz -
 Forskere identificerer ny katalysator til oprydning af nitritForskere ved Rice Universitys Catalysis and Nanomaterials Laboratory har fundet ud af, at guld- og palladium -nanopartikler hurtigt kan nedbryde nitritter. Kredit:M.S. Wong/Rice University Kemiske
Forskere identificerer ny katalysator til oprydning af nitritForskere ved Rice Universitys Catalysis and Nanomaterials Laboratory har fundet ud af, at guld- og palladium -nanopartikler hurtigt kan nedbryde nitritter. Kredit:M.S. Wong/Rice University Kemiske -
 Terraced grafen til ultrafølsom magnetfeltsensorFigur viser (til venstre) konceptet for den terrasserede enkeltlags grafenformation. Dette svarer til de terrasserede rismarker, der bruges meget i Asien til landbrug. (Højre) Atomkraftmikroskopibille
Terraced grafen til ultrafølsom magnetfeltsensorFigur viser (til venstre) konceptet for den terrasserede enkeltlags grafenformation. Dette svarer til de terrasserede rismarker, der bruges meget i Asien til landbrug. (Højre) Atomkraftmikroskopibille
- Kan bushbrandkrisen være vendepunktet i den australske klimapolitik?
- Historisk kuldioxidnedgang kan indeholde spor for fremtidens klima
- Lige tilskud overraskende kraftfulde, for at fremme brugen af guldstandard medicin, viser ny under…
- Walmart viser voldelige spil, men vil stadig sælge våben
- To nye væsner opdaget fra begyndelsen af dyrelivet
- Mindre skalaløsninger er nødvendige for hurtige fremskridt hen imod emissionsmål


