Nye antimikrobielle midler til at bekæmpe superbugs
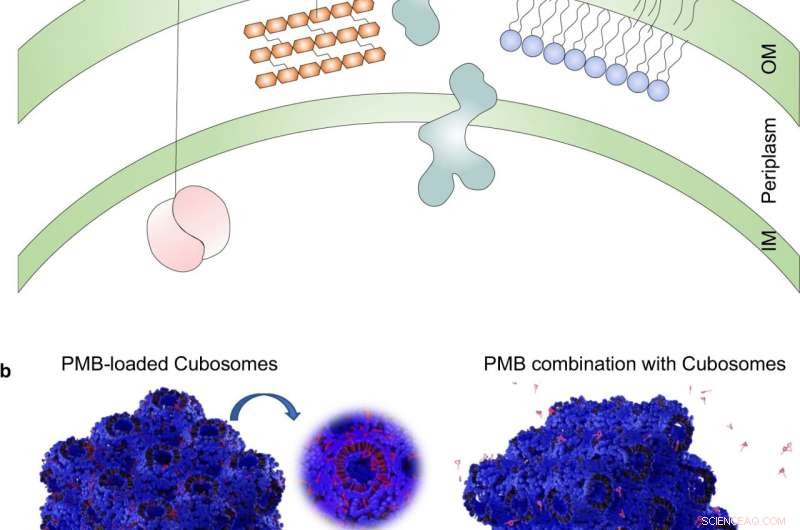
Fig. 1:Interaktionen mellem antibiotika og cubosomer med gramnegative bakterier. en skematisk fremstilling af OM-dobbeltlaget udsat for forskellige antibiotika, som almindeligvis anvendes til behandling af gramnegative bakterier. Amikacin binder sig irreversibelt til 30S-underenheden af bakterielle ribosomer, interfererer med mRNA-binding og tRNA-acceptorsteder og blokerer derved proteinsyntese og hæmmer bakteriel vækst; Aztreonam hæmmer syntesen af bakteriecellevæggen ved at blokere peptidoglycan-tværbinding. Doripenem inaktiverer PBP'er ved at danne stabile acyl-enzymer, hvilket resulterer i en svækket cellevæg; PMB interagerer med lipopolysaccharid (LPS) af OM af Gram-negative bakterier, hvilket forårsager lækage af cytoplasmatisk indhold og til sidst celledød. b Skematisk diagram af PMB-ladede cubosomer og polyterapibehandlingen, der interagerer med den gramnegative bakterielle OM. OM ydre membran, IM indre membran, PBPs penicillin-bindende proteiner, mRNA messenger ribonukleinsyre, tRNA transfer ribonukleinsyre, PMB polymyxin B. Kredit:DOI:10.1038/s41467-022-28012-5
Forskere fra Monash University har opdaget en potentiel ny måde at forhindre antibiotikaresistens på og reducere antibiotikaindtaget.
Verdenssundhedsorganisationen (WHO) har erklæret antimikrobiel resistens for at være blandt de 10 største globale trusler mod folkesundheden.
Antimikrobiel resistens opstår, når patogener (bakterier, vira, svampe og parasitter) ændrer sig over tid og ikke længere reagerer på medicin, som følge heraf bliver infektioner stadig sværere eller umulige at behandle.
Undersøgelsen, "En polyterapibaseret tilgang til bekæmpelse af antimikrobiel resistens ved hjælp af cubosomer," offentliggjort i Nature Communications , har fundet ud af, at brugen af nanopartikler i kombination med andre antibiotika er en effektiv strategi til at forbedre bakteriedræbningen.
Artiklen giver et vigtigt nyt bidrag til området for antimikrobiel resistens og finder en ny vej frem til at bekæmpe multiresistente bakterier.
"Dette er en forbløffende opdagelse af, hvordan vi leverer medicin, og hvordan den medicin, vi tager, påvirker os i fremtiden," siger ledende forsker Dr. Hsin-Hui Shen.
Dr. Shen fra Monash University Department of Materials Science and Engineering og professor Jian Li fra Monash Biomedicine Discovery Institute og Department of Microbiology har påvist, at nanopartikelbaserede polyterapibehandlinger forstyrrer den ydre membran af superbug-bakterier og tilbyder en forbedret alternativ til den konventionelle brug af indlæsning af antibiotika i lipid nanopartikler.
"Når bakterier bliver resistente, kan de originale antibiotika ikke længere dræbe dem. I stedet for at lede efter nye antibiotika til at modvirke superbugs, kan vi bruge den nanoteknologiske tilgang til at reducere dosis af antibiotikaindtag, og dermed effektivt dræbe multiresistente organismer," siger Dr. Shen.
WHO har bekræftet, at der ikke er blevet opdaget noget nyt antibiotikum i de sidste 30 år, men globalt er der en krise med antibiotikaresistens, hvilket betyder, at flere mennesker i de kommende år vil dø af basale infektioner, fordi de har udviklet antimikrobiel resistens.
WHO siger, at omkostningerne ved antimikrobiel resistens for økonomien er betydelige, og uden effektive antimikrobielle stoffer ville succesen med moderne medicin i behandling af infektioner, herunder under større operationer og cancerkemoterapi, være i øget risiko.
"I lang tid er nanopartikler blevet brugt specifikt som antimikrobielle bærere, men brugen af nanopartikler i polyterapibehandlinger med antibiotika for at overvinde antimikrobiel resistens er blevet overset," siger Dr. Shen.
"Brugen af kombinationsbehandling med nanopartikler og antibiotika kan reducere dosisindtagelsen i den menneskelige krop og overvinde multilægemiddelresistensen."
Forskningen går nu videre til testfasen. + Udforsk yderligere
Lav antibiotikakoncentration i miljøet nok til at øge antimikrobiel resistens under laboratorieforhold
 Varme artikler
Varme artikler
-
 Forskere skal udvikle langtidsholdbart batteri med uortodokse metoderKredit:CC0 Public Domain Forskere fra National Research Nuclear University MEPhI (Rusland) udvikler radioisotop beta-voltaiske batterier med nikkel-63 nano-cluster radioisotopfilm. Konceptet er at
Forskere skal udvikle langtidsholdbart batteri med uortodokse metoderKredit:CC0 Public Domain Forskere fra National Research Nuclear University MEPhI (Rusland) udvikler radioisotop beta-voltaiske batterier med nikkel-63 nano-cluster radioisotopfilm. Konceptet er at -
 Spolede nanotråde kan indeholde nøglen til strækbar elektronikZhus forskerhold har skabt de første spoler af silicium nanotråd på et substrat, der kan strækkes til mere end det dobbelte af deres oprindelige længde, flytte os tættere på at udvikle strækbare elekt
Spolede nanotråde kan indeholde nøglen til strækbar elektronikZhus forskerhold har skabt de første spoler af silicium nanotråd på et substrat, der kan strækkes til mere end det dobbelte af deres oprindelige længde, flytte os tættere på at udvikle strækbare elekt -
 I ikke-flygtige hukommelsesteknologier kan 2D-materialer drive et stort spring fremadKredit:CC0 Public Domain Ikke-flygtige hukommelser - som er i stand til at gemme information, selv når strømmen er afbrudt - bruges i vid udstrækning i computere, tablets, pen-drev og mange andre e
I ikke-flygtige hukommelsesteknologier kan 2D-materialer drive et stort spring fremadKredit:CC0 Public Domain Ikke-flygtige hukommelser - som er i stand til at gemme information, selv når strømmen er afbrudt - bruges i vid udstrækning i computere, tablets, pen-drev og mange andre e -
 Kvægs blod holder guld nanopartikler stabileTo hætteglas i et Rice University -laboratorium viser guldnanopartikler i saltvand. Til venstre, nanopartiklerne er blevet stabiliseret i bovint serumalbumin og er dispergeret i opløsningen. Til højre
Kvægs blod holder guld nanopartikler stabileTo hætteglas i et Rice University -laboratorium viser guldnanopartikler i saltvand. Til venstre, nanopartiklerne er blevet stabiliseret i bovint serumalbumin og er dispergeret i opløsningen. Til højre
- Kæmpe A-68 isbjerg tre år senere
- Stater sigter mod at stoppe internetudgivelsen af 3D-printede våbenplaner
- Ny analyse tyder på, at bevarelse af sjældne arter er afgørende for tropiske skove
- Begrænsende faktorer i økosystemet
- Sådan rapporterer du Z-score-resultater
- Open source-software låser op for 3D-visning af nanomaterialer


