Ingeniører udvikler en ny metode til fremstilling af CAR T-celler ved hjælp af lipid-nanopartikler
For patienter med visse typer kræft har CAR T-celleterapi været intet mindre end livsændrende. Udviklet til dels af Carl June, Richard W. Vague Professor ved Perelman School of Medicine, og godkendt af Food and Drug Administration (FDA) i 2017, mobiliserer CAR T-celleterapi patienters eget immunsystem til at bekæmpe lymfom og leukæmi, bl.a. andre kræftformer.
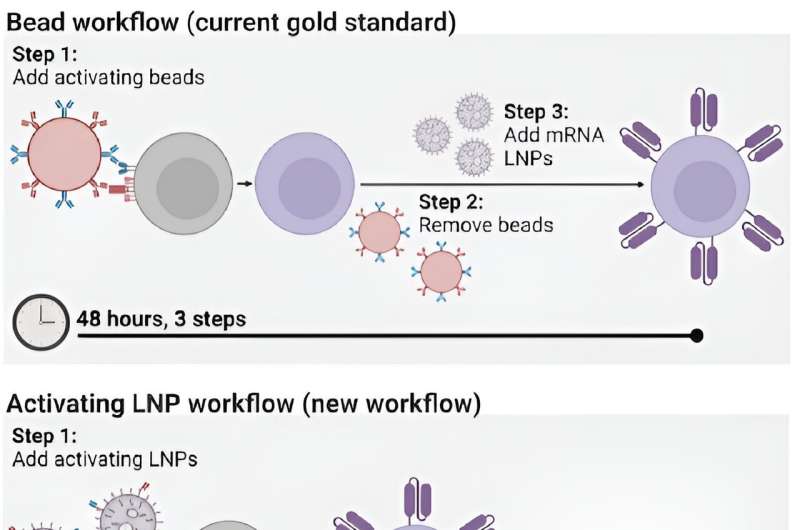
Processen til selv at fremstille CAR T-celler er dog tidskrævende og dyr og kræver flere trin på tværs af dage. Processen involverer at udtrække patienters T-celler og derefter aktivere dem med små magnetiske perler, før de giver T-cellerne genetiske instruktioner om at lave kimære antigenreceptorer (CAR'er), de specialiserede receptorer, der hjælper T-celler med at eliminere kræftceller.
Nu har Penn Engineers udviklet en ny metode til fremstilling af CAR T-celler, en der kun tager 24 timer og kun kræver et trin, takket være brugen af lipid nanopartikler (LNP'er), de potente leveringsmidler, der spillede en afgørende rolle i Moderna og Pfizer-BioNTech COVID-19-vacciner.
I et nyt papir offentliggjort i Advanced Materials beskriver Michael J. Mitchell, lektor i bioteknik, skabelsen af "aktiverende lipid-nanopartikler" (aLNP'er), som kan aktivere T-celler og levere de genetiske instruktioner til CAR'er i et enkelt trin, meget forenkling af CAR T-cellefremstillingsprocessen.
"Vi ønskede at kombinere disse to ekstremt lovende forskningsområder," siger Ann Metzloff, ph.d.-studerende og kandidatforsker i Mitchell-laboratoriet og papirets hovedforfatter. "Hvordan kunne vi anvende lipid-nanopartikler til CAR T-celleterapi?"
På nogle måder fungerer T-celler som en militær reserveenhed:I helbredstider forbliver de inaktive, men når de opdager patogener, mobiliserer de og udvider hurtigt deres antal, før de vender sig mod truslen. Kræft udgør en unik udfordring for denne forsvarsstrategi. Da kræftceller er kroppens egne, behandler T-celler ikke automatisk kræft som farligt, og derfor er det nødvendigt først at "aktivere" T-celler og levere kræftdetekterende CAR'er i CAR T-celleterapi.
Indtil nu har det mest effektive middel til at aktivere T-celler været at udtrække dem fra en patients blodbane og derefter blande disse celler med magnetiske perler knyttet til specifikke antistoffer - molekyler, der fremkalder et immunrespons. "Perlerne er dyre," siger Metzloff. "De skal også fjernes med en magnet, før du klinisk kan administrere T-cellerne. Men ved at gøre det mister du faktisk også mange af T-cellerne."
Lavet primært af lipider, de samme vandafvisende molekyler, som udgør husholdningsmadlavningsfedt som smør og olivenolie, har lipidnanopartikler vist sig enormt effektive til at levere sarte molekylære nyttelaster. Deres kapsellignende form kan omslutte og beskytte mRNA, som giver instruktioner til celler til at fremstille proteiner. På grund af den udbredte brug af COVID-19-vaccinerne, siger Metzloff, "Sikkerheden og effektiviteten af lipid-nanopartikler er blevet vist i milliarder af mennesker rundt om i verden."
For at inkorporere LNP'er i produktionen af CAR T-celler spekulerede Metzloff og Mitchell på, om det kunne være muligt at binde de aktiverende antistoffer, der bruges på de magnetiske perler, direkte til overfladen af LNP'erne. Anvendelse af LNP'er på denne måde, mente de, kunne gøre det muligt helt at eliminere behovet for at aktivere perler i produktionsprocessen. "Dette er nyt," siger Metzloff, "fordi vi bruger lipid-nanopartikler ikke kun til at levere mRNA-kodende CAR'er, men også til at starte en fordelagtig aktiveringstilstand."
I løbet af to år optimerede Metzloff omhyggeligt designet af aLNP'erne. En af de primære udfordringer var at finde det rigtige forhold mellem et antistof og et andet. "Der var mange valg at træffe," husker Metzloff, "da dette ikke var blevet gjort før."
Ved at binde antistofferne direkte til LNP'er var forskerne i stand til at reducere antallet af trin involveret i processen med at fremstille CAR T-celler fra tre til én og halvere den nødvendige tid, fra 48 timer til kun 24 timer. "Dette vil forhåbentlig have en transformativ effekt på processen til fremstilling af CAR T-celler," siger Mitchell. "Det tager i øjeblikket så lang tid at lave dem, og derfor er de ikke tilgængelige for mange patienter rundt om i verden, der har brug for dem."
CAR T-celler, der er fremstillet ved hjælp af aLNP'er, skal endnu testes på mennesker, men i musemodeller havde CAR T-celler, der blev skabt ved hjælp af den proces, der er beskrevet i papiret, en betydelig effekt på leukæmi, hvilket reducerede størrelsen af tumorer og demonstrerede derved teknologiens gennemførlighed .
Metzloff ser også yderligere potentiale for aLNP'er. "Jeg tror, at aLNP'er kunne udforskes mere bredt som en platform til at levere andre laster til T-celler," siger hun. "Vi demonstrerede i dette papir en specifik klinisk anvendelse, men lipid-nanopartikler kan bruges til at indkapsle mange forskellige ting:proteiner, forskellige typer af mRNA. aLNP'erne har bred potentiel anvendelighed til T-cellekræftterapi som helhed, ud over dette ene mRNA CAR T-celleapplikation, som vi har vist her."
Flere oplysninger: Ann E. Metzloff et al., Antigen Presenting Cell Mimetic Lipid Nanopartikler til Rapid mRNA CAR T Cell Cancer Immunotherapy, Avancerede materialer (2024). DOI:10.1002/adma.202313226
Journaloplysninger: Avanceret materiale
Leveret af University of Pennsylvania
 Varme artikler
Varme artikler
-
 Forskere finder enkle, billig måde at øge solcelleeffektivitetenKredit:North Carolina State University Forskere fra North Carolina State University og det kinesiske videnskabsakademi har fundet en nem måde at ændre den molekylære struktur af en polymer, der al
Forskere finder enkle, billig måde at øge solcelleeffektivitetenKredit:North Carolina State University Forskere fra North Carolina State University og det kinesiske videnskabsakademi har fundet en nem måde at ændre den molekylære struktur af en polymer, der al -
 Byg sikrere medicinsk udstyr med innovativ beskyttende nanopartikelbelægningKredit:Unsplash/CC0 Public Domain Hvert år, over en million mennesker udvikler sundhedserhvervede infektioner under deres hospitalsophold. Og omkring 100, 000 af dem dør af de komplikationer. Men
Byg sikrere medicinsk udstyr med innovativ beskyttende nanopartikelbelægningKredit:Unsplash/CC0 Public Domain Hvert år, over en million mennesker udvikler sundhedserhvervede infektioner under deres hospitalsophold. Og omkring 100, 000 af dem dør af de komplikationer. Men -
 Forskere observerer rettet energitransport mellem nabomolekyler i et nanomaterialeMed hjælp fra ultrakorte laserimpulser studerer fysikere ved Universitetet i Oldenburg de ultrahurtige processer, der sker i nanomaterialer efter absorption af lys. Kredit:Universitetet i Oldenburg
Forskere observerer rettet energitransport mellem nabomolekyler i et nanomaterialeMed hjælp fra ultrakorte laserimpulser studerer fysikere ved Universitetet i Oldenburg de ultrahurtige processer, der sker i nanomaterialer efter absorption af lys. Kredit:Universitetet i Oldenburg -
 Uhæmmelig smerte kan finde lindring i små guldstængerForskere har udviklet en teknik, der kan føre til terapier til smertelindring hos mennesker med ulidelig smerte, muligvis inklusiv kræftrelateret smerte. Kredit:Kyoto Universitys Institute for Integra
Uhæmmelig smerte kan finde lindring i små guldstængerForskere har udviklet en teknik, der kan føre til terapier til smertelindring hos mennesker med ulidelig smerte, muligvis inklusiv kræftrelateret smerte. Kredit:Kyoto Universitys Institute for Integra
- EU skal lukke kulværker inden 2030 for at imødekomme klimaløfte:undersøgelse
- At sætte undersøgte terrorister under et mikroskop
- Iran flytter for at redde sidste maskot asiatiske geparder
- Billede af højeksplosive detonatorer
- Udbredt brug af PFAS i kosmetik, ny undersøgelse finder
- Borgervidenskab og padlesurfing for at studere mikroplastikforurening på Barcelonas kystlinje


