Naturen inspirerer til en ny bølge af bioteknologi
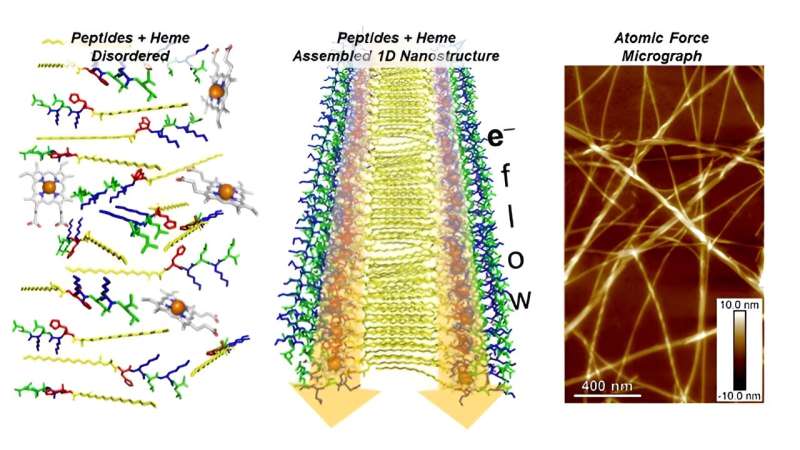
Biologiske molekyler kaldet peptider spiller en nøglerolle i mange biologiske aktiviteter, herunder transport af ilt og elektroner. Peptider består af korte kæder af aminosyrer, byggestenene i proteiner. De er også inspirationen til nye former for bioteknologi.
Forskere er ved at udvikle en syntetisk form af et peptid, der selv samles til fibre i nanoskala, der leder elektricitet, når de kombineres med hæm. Hæm er et stof, der hjælper proteiner i naturen med at flytte elektroner fra et sted til et andet.
Forskerne fastslog, hvordan deres peptidnanofibres elektriske ledningsevne blev påvirket af længden af sekvensen af aminosyrer i peptidet og deres identitet
Strukturelle parametre for peptider i naturen bestemmer deres funktion og deres løfte for bioteknologi. Disse parametre inkluderer sekvenslængde - længden af de peptidsegmenter, der udgør komplette peptidkæder. De inkluderer også, hvordan nogle aminosyrer er arrangeret i et peptid. Forskningen blev publiceret i tidsskriftet Nanoscale i juni 2022.
Denne undersøgelses resultater hjælper forskere med at designe peptidsamlinger, der danner fibre i nanoskala og transporterer elektroner over lange afstande, hvilket kan gøre disse fibre nyttige i medicinsk udstyr, biosensorer til en bred vifte af applikationer og robotteknologi. De har også lovende i udviklingen af nye enzymer, som virksomheder bruger til at fremstille og forbedre ting såsom medicinske og husholdningsrengøringsprodukter.
Felter inden for materiale- og biokemiforskning udforsker protein- og peptidnanostrukturer, der findes i naturen. Disse nanostrukturer viser meget lovende som bioelektroniske materialer. Udviklingen af en syntetisk analog, der er i stand til at danne endimensionelle (1D) nanostrukturer, ville i høj grad forbedre videnskabsmænds forståelse af det naturlige system og give en platform for udvikling af nye materialer.
Forskere ved Center for Nanoscale Materials ved Argonne National Laboratory undersøgte en række peptider, der selv samles i 1D lagdelte nanostrukturer. Peptiderne PA-(Kx)n betegnes blot som PA-Kxn, hvor PA er c16-AH, hvor c16-A er modificeret alanin (A), og H er histidin, K er lysin, n er sekvensens gentagelseslængde (1– 4), og x er aminosyren leucin (L), isoleucin (I) eller phenylalanin (F).
Holdet fastslog, hvordan længden af peptidsekvensen (n) og identiteten af den hydrofobe aminosyre påvirker nøglefaktorer:bindingsaffiniteten af hæm til præ-samlede peptider, hæmdætheden og de elektroniske egenskaber.
Med en sekvenslængde på 2 gav peptidsamlingen den største bindingsaffinitet. De resulterende nanoskalasamlinger producerede ordnede arrays af det elektroaktive molekylehæm. Alle peptiderne, med undtagelse af PA-KL1, havde nanofibre med et langt aspektforhold uanset gentagen enhedslængde og sekvens. Sådanne strukturer har potentiel anvendelighed som supramolekylære bioelektroniske materialer, der er nyttige i biomedicinsk sansning og udvikling af enzymatiske materialer.
Flere oplysninger: H. Christopher Fry et al., Designing 1D multiheme peptid amphiphile assemblies, der minder om naturlige systemer, Nanoscale (2022). DOI:10.1039/D2NR00473A
Journaloplysninger: Nanoskala
Leveret af det amerikanske energiministerium
 Varme artikler
Varme artikler
-
 Ny rekord i nanoelektronik ved ultralave temperaturerIllustration af enkeltelektron-tunneling gennem en oxidtunnelbarriere i den primære termometerindretning. Den målte tunnelstrøm bruges til at bestemme den absolutte elektrontemperatur. Kredit:VTT
Ny rekord i nanoelektronik ved ultralave temperaturerIllustration af enkeltelektron-tunneling gennem en oxidtunnelbarriere i den primære termometerindretning. Den målte tunnelstrøm bruges til at bestemme den absolutte elektrontemperatur. Kredit:VTT -
 Forskere bruger lipid-nanopartikler til præcist at målrette genredigering til leverenForskere udviklede nanopartikler, der bærer en genredigeringspakke specifikt til leveren hos mus, med succes at reducere niveauet af LDL dårligt kolesterol i blodet. Sammen med tidligere undersøgelser
Forskere bruger lipid-nanopartikler til præcist at målrette genredigering til leverenForskere udviklede nanopartikler, der bærer en genredigeringspakke specifikt til leveren hos mus, med succes at reducere niveauet af LDL dårligt kolesterol i blodet. Sammen med tidligere undersøgelser -
 Advance muliggør muligvis 2D-transistorer til mindre mikrochipkomponenterVed grænsefladen mellem semimetallet (vismut) og 2D-halvlederen (MoS2), der er ingen energibarriere for elektronen at gå igennem, hvilket fører til en ultralav kontaktmodstand mellem dem. Kredit:Massa
Advance muliggør muligvis 2D-transistorer til mindre mikrochipkomponenterVed grænsefladen mellem semimetallet (vismut) og 2D-halvlederen (MoS2), der er ingen energibarriere for elektronen at gå igennem, hvilket fører til en ultralav kontaktmodstand mellem dem. Kredit:Massa -
 Forskere lyser celler ved hjælp af nanoark til kræftbehandlingDette billede demonstrerer nanoarks fotoresponsevne, når de udsættes for nær infrarødt lys. Dr. Akhilesh Gaharwar og hans team eksperimenterer med disse nanoark for at se, hvordan de kan påvirke celle
Forskere lyser celler ved hjælp af nanoark til kræftbehandlingDette billede demonstrerer nanoarks fotoresponsevne, når de udsættes for nær infrarødt lys. Dr. Akhilesh Gaharwar og hans team eksperimenterer med disse nanoark for at se, hvordan de kan påvirke celle
- Fysikere demonstrerer ny måde at krænke lokal kausalitet
- NASAs kredsløb om Carbon Observatory-3 får første data
- Hvad skete der med Marss vand? Den er stadig fanget der
- Ingeniør afslører nyt spin på fremtiden for transistorer med nyt design
- Lærere er mere deprimerede og angste end den gennemsnitlige australier
- Dinosaur-mumie:Forskere mener, at de har fundet en af de bedst bevarede dinosaurer nogensinde


