Undersøgelse af biofordelingen og funktionen af polymer-DNA origami nanostrukturer

Evnen til at regulere biodistributionen af lægemidler er en meget ønsket egenskab, der kan begrænse bivirkningerne af mange lægemidler. I en ny undersøgelse i Scientific Reports , Noah Joseph, og et team af bioteknologiske og nanovidenskabelige forskere i Israel, beskriver et middel i nanoskala udviklet fra en koblet polymer-DNA origami-hybrid, der er i stand til at udvise stabilitet i serum og langsom diffusion gennem væv.
Ved at koble til fragmenter af polyethylenglycol gennem elektrostatiske polyamin-interaktioner bemærkede teamet markant stabilitet af midlerne in vivo, hvor mere end 90 % af bestanddelene bibeholdte strukturelle integritet i fem dage efter subkutan injektion.
Resultaterne fremhæver polymer-DNA hybrid nanostrukturer som levedygtige farmakologiske midler, der kan indgå i almindelige teknologier, herunder deres anvendelse som monoklonale antistoffer til lægemiddelaktivitet.
DNA-origami-terapi
Mange lægemidler, herunder små molekyler og biologiske stoffer, fungerer systematisk uden den medfødte kapacitet til distribution og funktion. Dette er den centrale drivkraft bag uønskede virkninger og en vigtig komponent i lægemiddelsvækkelse for mange nye lægemidler i kliniske forsøg og klinisk brug.
Mens der i de seneste årtier er blevet gjort en stor indsats for at opnå regulering af lægemiddelaktivitet, repræsenterer de godkendte lægemidler på nuværende tidspunkt kun en lille brøkdel af det sande potentiale af lægemidlers terapeutiske mekanismer.
Monoklonale antistoffer er en mainstream og velafprøvet farmaceutisk metode, der eksemplificerer denne udfordring. De monoklonale lægemidler har muliggjort banebrydende behandlinger af sygdomme, der hidtil har været anset for næsten ubehandlelige inden for onkologi, immunologi og inflammatoriske sygdomme. Scaffolded DNA origami er en metode til at udvikle DNA-nanostrukturer og lette den præcise rumlige regulering og funktionalitet på sub-nm-skalaen.
En ny strategi for DNA-terapi
De unikke egenskaber er velegnede på tværs af en række forskningsfelter for at markere dem som næste generations terapeutiske og diagnostiske midler. En række forskellige DNA-origami-funktionaliseringsmetoder kan opnå højere funktionel kompleksitet sammenlignet med monoklonale antistoffer.
I denne nye strategi præsenteret af Joseph og kolleger lettede holdet den rumlige regulering af lægemiddelaktivitet ved at koble polymer-DNA-origami-hybridmidler i nanoskala. Disse designs kan tilpasses på tværs af flere målproteiner til en række forskellige patologier med bred terapeutisk funktionalitet.
I dette arbejde præsenterede Joseph og kolleger en strategi for at levere terapeutiske lægemiddelbestanddele baseret på koblede polymer-DNA origami-hybridforbindelser på nanoskala. Ved at følge de sædvanlige, kinetiske og stabilitetskarakteriseringsundersøgelser af adskillige DNA-origami-konstruktioner in vivo, valgte forskerne en optimal DNA-nanostruktur som et proof-of-princip for terapeutiske applikationer med meget potente anti-inflammatoriske virkninger i en musemodel og i human tumor. Nekrosefaktor alfa.
Eksperimenterne
For at begynde proof-of-feasibility-undersøgelsen valgte forskerholdet tre forskellige DNA-origami-nanostrukturer med lignende masse og analyserede dem med gelelektroforese for at bestemme bulkkvaliteten. De brugte transmissionselektronmikroskopi før og efter coating af DNA-nanostrukturerne med polyethylenglycosylat-polylysin gennem amin- og fosfatinteraktioner for at øge massen af DNA og øge deres binding til polyethylenglycosylat og sikre stabiliteten af DNA-origaminanostrukturerne.
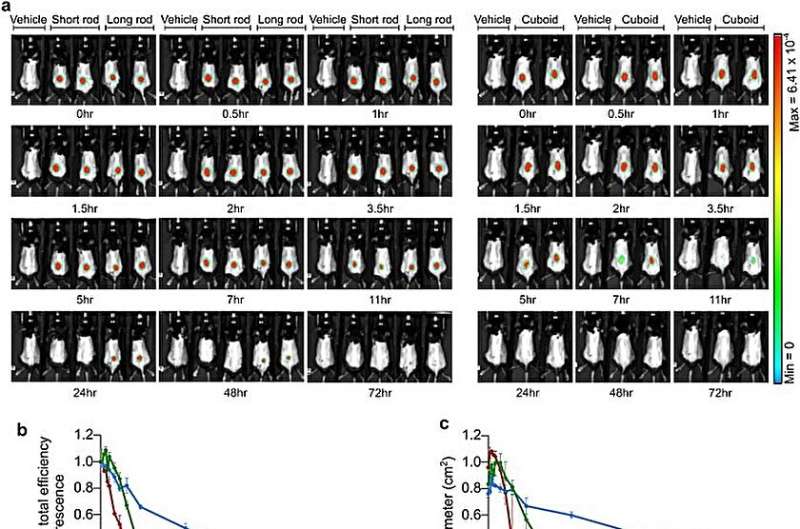
Lægemidler med in vivo-stabilitet er velegnede til distribution, og holdet undersøgte dette ved at udføre levende billeddannelse af mus behandlet med de polymer-coatede nanostrukturer administreret subkutant i knæled eller intraperitonealt i mus.
Mens den lange stang viste forlænget diffusion gennem tiden, var det muligt at kombinere langsommere diffusion med større stabilitet subkutant. Forskerne undersøgte kinetikken og in vivo-stabiliteten af resultaterne for at udvælge polymertæller-nanostrukturerne som effektive bestanddele til lægelige eksperimenter.
Terapeutiske virkninger af DNA-origami-nanostrukturerne
Forskerne studerede de redesignede lange stang nanostrukturer til at repræsentere den menneskelige tumor nekrose faktor alfa aptamerer og forankrede dem ensartet på tværs af overfladestrukturerne. Joseph og kolleger analyserede funktionaliseringen af lange stav-DNA-origami-strukturer ved at bruge agarosegelelektroforese, transmissionselektronmikroskopi og atomkraftmikroskopi.
Holdet undersøgte stabiliteten af bestanddelene i humant serum i 10 dage og identificerede dets strukturelle integritet til biodistribution og in vivo undersøgelser.
Outlook
På denne måde beskriver Noah Joseph og forskerholdet in vivo-kinetikken af tre DNA-origami-nanostrukturer i forskellige former stabiliseret af polyethylenglycol-polylysin-polymeren. Forskerne valgte den optimale kandidat og funktionaliserede de lange stangs nanostrukturer ved at fastgøre alfa-aptamerer fra human tumornekrosefaktor for at målrette det humane tumornekrosefaktor-alfaprotein.
Forskerholdet beskriver det terapeutiske potentiale af de funktionaliserede co-polymer DNA origami nanostrukturer til at fungere på tværs af komplekse biologiske miljøer. De kombinerede resultater fremhæver indflydelsen af DNA-nanostrukturerne som et væsentligt terapeutisk middel til præcisionsmedicin og funktionalitet af terapeutiske midler.
Flere oplysninger: Noah Joseph et al, Biodistribution og funktion af koblede polymer-DNA origami nanostrukturer, Videnskabelige rapporter (2023). DOI:10.1038/s41598-023-46351-1
Journaloplysninger: Videnskabelige rapporter , Videnskabelige fremskridt
© 2023 Science X Network
 Varme artikler
Varme artikler
-
 Hjælper materialer med at håndtere ekstrem stressVigtige trykvands-atomreaktorkomponenter fremstilles af en nikkel-baseret legering, der indeholder dobbelt så meget krom som det tidligere anvendte materiale. Den nye legering, kaldet legering 690, pr
Hjælper materialer med at håndtere ekstrem stressVigtige trykvands-atomreaktorkomponenter fremstilles af en nikkel-baseret legering, der indeholder dobbelt så meget krom som det tidligere anvendte materiale. Den nye legering, kaldet legering 690, pr -
 Grafenbaserede bærbare e-tekstiler bevæger sig tættere på kommerciel produktionDemonstration af laboratorie-skala pad-tør enhed og illustration af pad-tør enhed proces. Illustration af Daniel Wand. Kredit:Karim et al. © 2017 American Chemical Society Markedet for e-tekstilbe
Grafenbaserede bærbare e-tekstiler bevæger sig tættere på kommerciel produktionDemonstration af laboratorie-skala pad-tør enhed og illustration af pad-tør enhed proces. Illustration af Daniel Wand. Kredit:Karim et al. © 2017 American Chemical Society Markedet for e-tekstilbe -
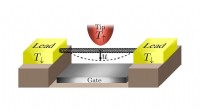 Nano -system fungerer med interagerende elektroner, men ingen elektrisk strømI det foreslåede system, et carbon nanorør er suspenderet mellem to ledninger, under en spidselektrode, og over en port. Parret og spidsen er to separate elektronreservoirer med forskellige temperatur
Nano -system fungerer med interagerende elektroner, men ingen elektrisk strømI det foreslåede system, et carbon nanorør er suspenderet mellem to ledninger, under en spidselektrode, og over en port. Parret og spidsen er to separate elektronreservoirer med forskellige temperatur -
 Spontan forbrænding i nanoboblerDannelse af bobler ved elektroderne under elektrolyse (kan ses i a og b). Situationer c, d, og e viser dannelsen af både brint og oxygen til venstre, brint alene i midten og ilt alene til højre. Sit
Spontan forbrænding i nanoboblerDannelse af bobler ved elektroderne under elektrolyse (kan ses i a og b). Situationer c, d, og e viser dannelsen af både brint og oxygen til venstre, brint alene i midten og ilt alene til højre. Sit
- Facebook idømt en bøde i Sydkorea for at begrænse brugeradgang
- Art Institute of Chicago løfter sløret for nøgleresultater inden for afrikansk kunst takket være…
- Analyse:Skal du købe den nye iPhone 5?
- Volkswagen satser 15 milliarder euro på elbiler i Kina
- Hvilende grå revhajer ændrer, hvad vi ved om, hvordan de trækker vejret
- Hyperspektral opløsning stimuleret Raman-spektroskopi med forstærkede fs-pulsudbrud


