Den rigtige måde at reparere DNA på
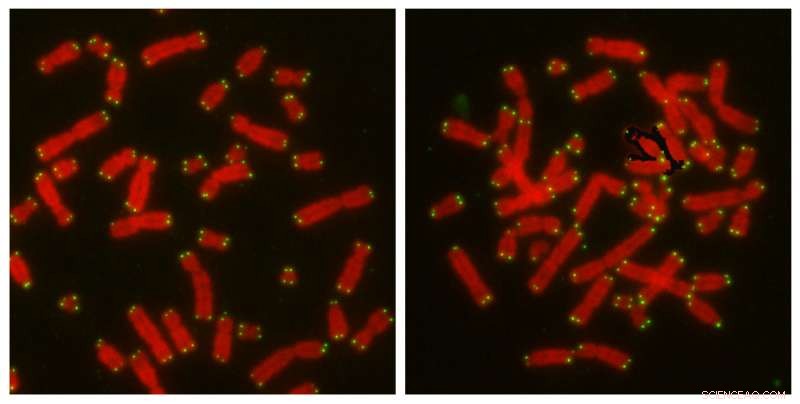
Salk-forskere opdager, at CYREN-mikroprotein hjælper celler med at vælge den bedste vej til at reparere gener og undgå kræft. Til venstre:Kromosomer (røde) med telomerer (grønne), der er uforstyrrede, forbliver uberørte og adskilte. Til højre:når CYREN er fraværende, kromosomer, der er blevet forstyrret for kunstigt at udløse NHEJ, viser fusioner, der er karakteristiske for reparation efter DNA er kopieret. Kredit:Salk Instituttet
Er det bedre at udføre en opgave hurtigt og lave fejl, eller gøre det langsomt, men perfekt? Når det kommer til at beslutte, hvordan man løser brud i DNA, celler står over for det samme valg mellem to store reparationsveje. Beslutningen har betydning, fordi det forkerte valg kan forårsage endnu flere DNA-skader og føre til kræft.
Forskere fra Salk Institute fandt ud af, at et lillebitte protein kaldet CYREN hjælper celler med at vælge den rigtige vej på det rigtige tidspunkt, afklare et mangeårigt mysterium om DNA-reparation og tilbyde forskerne et kraftfuldt værktøj, der kunne guide bedre behandlinger for kræft. Værket optræder i Natur den 20. september, 2017.
"At belyse DNA-reparationsveje er afgørende for at forstå, hvordan de nogle gange kan være giftige, siger Jan Karlseder, en professor i Salks Molecular and Cell Biology Laboratory og seniorforfatter til det nye papir. "Vores opdagelse af CYRENs funktion bidrager ikke kun til vores viden, det giver os et nyt værktøj til potentielt at bekæmpe kræft."
Dobbeltstrenget brud, de alvorligste skader, der sker på DNA, kan repareres ad en af to veje:en hurtig, men fejltilbøjelig proces kendt som NHEJ (non-homologous end joining) og en langsommere, fejlfri vej kendt som HR (homolog rekombination). Den hurtigere vej forbinder effektivt knækkede tråde igen, men i tilfælde af flere brud kan det forbinde de forkerte to ender sammen, gør tingene meget værre for en celle. Den langsommere vej er fejlfri, fordi den er afhængig af at have en ubeskadiget DNA-sekvens til at guide reparationen, men det betyder, at den kun kan fungere, efter at en celle har kopieret sin genetiske information for at dele sig. I betragtning af det, den hurtige vej fungerer udelukkende før DNA kopieres, selvom dets maskineri er så effektivt og produktivt, at videnskabsmænd har undret sig over, hvorfor det ikke udkonkurrerer de langsommere, mere præcis vej efter kopiering, også. Forskere har længe haft mistanke om, at noget må holde den hurtigere mulighed tilbage i disse tilfælde.
Det noget, det nye værk afslører, er et mikroprotein kaldet CYREN, som hæmmer den hurtigere vej, når en DNA-kopi er tilgængelig for den langsommere vej at bruge. CYREN blev opdaget af en anden Salk-forsker, Alan Saghatelian, som en del af en indsats i 2015 for at identificere små proteiner kaldet "korte ORF-kodede peptider" eller SEP'er, som i stigende grad viser sig at have kritiske biologiske roller.

Den rigtige måde at reparere DNA på. Denne tegneserie illustrerer den undertrykkende effekt af CYREN på den normalt hurtigere NHEJ DNA-reparationsvej, giver den langsommere HR-vej en chance for at komme videre. Kredit:Salk Instituttet
"Vi fandt mange af disse peptider i vores tidligere undersøgelse, men vi vidste ikke rigtig, om nogen af dem var vigtige, før Karlseder-laboratoriet blev involveret, " siger Saghatelian, en professor i Clayton Foundation Laboratories for Peptide Biology og en af artiklens medforfattere. "Takket være dette imponerende nye værk, vi ved nu, at der er nogle virkelig vigtige molekyler blandt de hundreder, vi opdager."
Saghatelians forskning havde antydet, at CYREN interagerede med hovedafbryderen på den hurtigere vej, et protein kaldet Ku. For at bestemme den nøjagtige karakter af interaktionen, Karlseders team arbejdede med en region af genomet, hvor reparation normalt undertrykkes for at forhindre farlige fusioner:enderne af kromosomerne, kaldet telomerer. Forskere kan kunstigt forstyrre telomerer for at aktivere den hurtige vej, gør det til et modelsystem til at teste CYRENs effekter.
"Telomerer tilbyder et fantastisk forskningsværktøj, fordi de virkelig har brug for at undertrykke reparation, men der er måder at aktivere reparationsmaskineriet på, så du kan studere det på en meget kontrolleret måde, " siger Nausica Arnoult, en Salk-forsker og førsteforfatter af papiret. Salk-teamet gjorde det, og fandt ud af, at med CYREN til stede, ingen reparationer skete efter cellen kopierede sit DNA, tyder på, at den slår hovedafbryderen af, Ku. Uden CYREN omkring, Ku's hurtige vej var aktiv både før DNA blev kopieret og efter.
Fordi telomereksperimenterne ikke fortalte holdet meget om konkurrencen mellem de hurtige og langsomme veje, Arnoult brugte derefter molekylære værktøjer til at sammenligne reparation i levende celler med og uden CYREN. Hun kombinerede DNA-saksen kendt som CRISPR med gener for fluorescerende proteiner, der ville blive udløst ved reparation, så hun kunne klippe DNA på bestemte måder og se ud fra den efterfølgende farve, hvilken vej der havde lavet reparationen. Hun analyserede også alle de proteininteraktioner, der fandt sted.
Disse eksperimenter afslørede, at CYREN binder sig direkte til Ku for at hæmme den hurtige vej både afhængigt af timing (før eller efter DNA-kopiering) og typen af DNA-brud (glat versus takket, for eksempel). Dens aktivitet kan endda justere forholdet mellem hurtige og langsomme reparationer.
"Vores undersøgelse viser, at CYREN er en vigtig regulator for valg af DNA-reparationsveje, siger Karlseder, som holder Donald og Darlene Shiley-stolen på Salk. "Arbejdet peger også på den spændende mulighed for potentielt at introducere DNA-skader i kræftceller og bruge CYREN til at forhindre dem i at foretage reparationer."
 Varme artikler
Varme artikler
-
 Ny statistisk metode til evaluering af reproducerbarhed i studier af genomorganisationSkematisk fremstilling af HiCRep-metoden. HiCRep bruger to trin til nøjagtigt at vurdere reproducerbarheden af data fra Hi-C eksperimenter. Trin 1:Data fra Hi-C-eksperimenter (repræsenteret i trekan
Ny statistisk metode til evaluering af reproducerbarhed i studier af genomorganisationSkematisk fremstilling af HiCRep-metoden. HiCRep bruger to trin til nøjagtigt at vurdere reproducerbarheden af data fra Hi-C eksperimenter. Trin 1:Data fra Hi-C-eksperimenter (repræsenteret i trekan -
 High School Biology EmnerKort sagt involverer biologi studiet af levende organismer, fra encellede organismer til flercellede planter, dyr og mennesker. Nogle grundlæggende biologiske klasseremner kan omfatte cellulær stru
High School Biology EmnerKort sagt involverer biologi studiet af levende organismer, fra encellede organismer til flercellede planter, dyr og mennesker. Nogle grundlæggende biologiske klasseremner kan omfatte cellulær stru -
 Bekæmpelse af virus:Kodebrydere gør kodeskrivereEn hårnålesløjfe fra et præ-mRNA. Fremhævet er nukleobaserne (grønne) og ribose-phosphat-rygraden (blå). Bemærk, at dette er en enkelt streng af RNA, der foldes tilbage på sig selv. Kredit:Vossman/ Wi
Bekæmpelse af virus:Kodebrydere gør kodeskrivereEn hårnålesløjfe fra et præ-mRNA. Fremhævet er nukleobaserne (grønne) og ribose-phosphat-rygraden (blå). Bemærk, at dette er en enkelt streng af RNA, der foldes tilbage på sig selv. Kredit:Vossman/ Wi -
 Tørke ikke dingoer bag det australske fastlands tigerudryddelse:undersøgelseThylacinen overlevede i den sydlige ø-stat Tasmanien indtil 1936, hvor den sidst kendte døde i fangenskab i Hobart Zoo, efter at arten blev jaget til udryddelse i naturen der i begyndelsen af 1900-t
Tørke ikke dingoer bag det australske fastlands tigerudryddelse:undersøgelseThylacinen overlevede i den sydlige ø-stat Tasmanien indtil 1936, hvor den sidst kendte døde i fangenskab i Hobart Zoo, efter at arten blev jaget til udryddelse i naturen der i begyndelsen af 1900-t
- Orkanen går mod Florida efter at have børstet de caribiske øer
- Hvordan bruges dioder i vores hverdagsliv?
- Nyt tilsætningsstof hjælper forskere mere selektivt med at omdanne CO2 til brændstoffer med flere…
- Tøjstof holder dig kølig i varmen
- Sådan viser du GPM-vandflow på en eksisterende Chiller
- Brugen af jargon dræber folks interesse for videnskab, politik


