Rovbakterier - jagten på en ny klasse af antibiotika
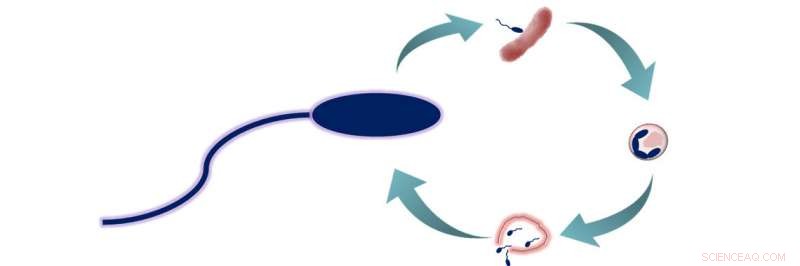
B. bacteriovorus prædationscyklus. B. bacteriovorus har to livsfaser:1) søgning efter bytte, og 2) ind i byttet og fodring. I denne anden fase, bakterierne spiser deres bytte indefra, lader dem vokse og forlænges, før de adskilles i 3 til 6 nye B. bacteriovorus-celler. Disse celler undslipper derefter det nu døde bytte og begynder en ny livscyklus. Kredit:American Chemical Society
I 2016 Verdenssundhedsorganisationen udnævnte antibiotikaresistens som "en af de største trusler mod global sundhed, mad sikkerhed, og udvikling i dag." Meddelelsen citerede en voksende liste over infektioner, såsom tuberkulose og gonoré, som bliver sværere at behandle hvert år, efterhånden som resistensen over for nuværende antibiotikabehandlinger øges. Alligevel er antibiotika afgørende - uden dem, menneskeheden ville blive plaget af vedvarende infektioner. Så hvad er løsningen for at sikre kontinuerlig behandling og samtidig tage fat på den alarmerende stigning i modstand?
En potentiel løsning ligger i en unik type rovbakterier, der lever af andre bakterier, som dem, der forårsager sygdomme. Kaldet "levende antibiotika, "Denne gruppe af kødædende fauna har fanget forskernes opmærksomhed, herunder dem ved Okinawa Institute of Science and Technology Graduate University (OIST). I et nyligt offentliggjort papir i ACS syntetisk biologi , OIST-forskere har taget de første skridt mod genetisk manipulation af en sådan lille kannibal, B. bacteriovorus. De har identificeret værktøjer, der kan tillade manipulation af gener, der påvirker denne bakteries rovdyrsadfærd.
"I fremtiden, vi ønsker at kontrollere prædationen af bakterierne - timingen og omfanget af prædationen, " forklarer Dr. Mohammed Dwidar fra Nucleic Acid Chemistry and Engineering Unit og første forfatter på papiret. "[I øjeblikket] mangler vi de grundlæggende tekniske værktøjer til at gøre dette."
B. bacteriovorus er uskadelig for mennesker, men alligevel dødelig for sit bytte – gramnegative bakterier – som omfatter skurke som E. coli, Salmonella, Legionella, og andre. Som sådan, at være i stand til at kontrollere det kunne potentielt behandle mange forskellige typer infektioner. Imidlertid, på grund af dets usædvanlige rovdyr og andre unikke egenskaber, genetisk manipulation af B. bacteriovorus har været begrænset.
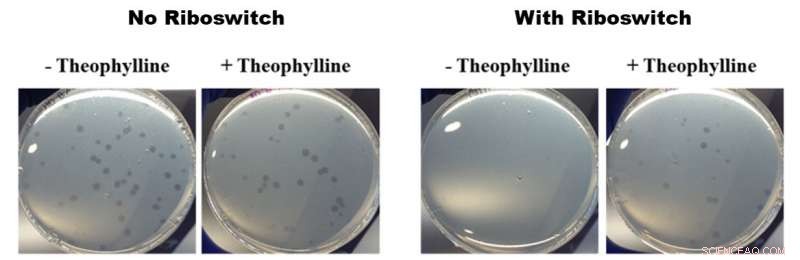
Effekter af theophyllin-aktiverede riboswitches på vækst af B. bacteriovorus. Alle billederne i figuren ovenfor viser petriskåle indeholdende B. bacteriovorus og dets bytte E. coli. De to billeder til venstre viser væksten af B. bacteriovorus i skåle, der ikke indeholder (-) og indeholder (+) theophyllin uden en riboswitch indsat i genomet. De to højre billeder viser væksten af B. bacteriovorus modificeret med en riboswitch i skåle, der ikke indeholder (-) og indeholder (+) theophyllin. De venstre billeder viser ingen forskel i vækst og de højre billeder viser hurtigere vækst i tilstedeværelsen af theophyllin, hvilket betyder, at de theophyllin-aktiverede riboswitches havde en effekt på B. bacteriovorus' prædatoriske adfærd. Kredit:American Chemical Society
OIST-forskerne brugte riboswitches, som er genekspressionskontrollerende værktøjer, der vides at fungere godt i andre bakterier, at tackle udfordringen med at forstå og manipulere B. bacteriovorus' prædation. Måden et gen udtrykkes på følger en specifik vej - DNA omdannes til RNA via transkription, RNA omdannes til proteiner via translation, og så udfører proteinerne forskellige funktioner. Riboswitchen kommer ind i oversættelsesfasen. Ved at sætte en riboswitch i begyndelsen af en streng af RNA, og derefter "aktivere" det med et kemikalie, riboswitchen kan starte eller stoppe RNA'et i at blive oversat til et protein.
Til deres studie, OIST-forskerne indsatte en riboswitch i et af de gener, der menes at være vigtige for B. bacteriovorus' rovdyrsadfærd:flagellær sigma-faktor fliA. De aktiverede det derefter med kemikaliet theophyllin. Efter at have anbragt de modificerede bakterier i petriskåle sammen med nogle lækre E. coli byttedyr, den modificerede B. bacteriovorus så ud til at formere sig hurtigere i nærvær af theophyllin end i dens fravær. Denne hurtigere formering antyder, at B. bacteriovorus konsumerede sit bytte hurtigere, og dermed formere sig hurtigere. Dette viser igen, at den predatoriske livscyklus kan styres af theophyllin.
Ud over det "levende antibiotikum"-slutmål, der er mange flere potentielle anvendelser for let manipulerbare B. bacteriovorus-celler. "Folk vil have økologisk mad uden kemikalier, " Dr. Dwidar forklarer. "De rovbakterier kan være et potentielt sikkert alternativ til antibakterielle midler for nogle plantesygdomme. Vi kan også bruge det til industrien, for eksempel, i vandbehandlingsanlæg."
"I fremtiden, du kan sprøjte disse bakterier på frisk mad for at beskytte mod madforgiftning, " Professor Yohei Yokobayashi, som også var involveret i forskningen, tilføjer.
Med OIST-forskernes resultater i hånden, næste skridt er at lære mere om B. bacteriovorus og de værktøjer, der kan være i stand til at kontrollere dens adfærd for en dag at realisere sit fulde antibiotiske potentiale.
Sidste artikelGræsspurve søger konstant efter et pænere hjem
Næste artikelSikkerhed, ikke mad, lokker gæs til byer
 Varme artikler
Varme artikler
-
 Kan en hjernescanning fortælle dig, om du vil blive kriminel?En hjernescanning kan fortælle dig, om en person har en tilbøjelighed til manglende empati, men det fortæller dig ikke, om de er kriminelle. John Greim/LightRocket via Getty Images Ville det ikke vær
Kan en hjernescanning fortælle dig, om du vil blive kriminel?En hjernescanning kan fortælle dig, om en person har en tilbøjelighed til manglende empati, men det fortæller dig ikke, om de er kriminelle. John Greim/LightRocket via Getty Images Ville det ikke vær -
 Pumaer er mere sociale end hidtil antagetPumaer er ikke så ensomme, som de engang så ud til. Her, to bjergløver deler mad i Wyoming. Kredit:Mark Ellbroch/Panthera Pumas, længe kendt som solitære kødædere, er mere sociale end hidtil antag
Pumaer er mere sociale end hidtil antagetPumaer er ikke så ensomme, som de engang så ud til. Her, to bjergløver deler mad i Wyoming. Kredit:Mark Ellbroch/Panthera Pumas, længe kendt som solitære kødædere, er mere sociale end hidtil antag -
 Hvor langt rejser invasive arter?Den orange daglilje er en fremmed art i Centraleuropa og blev introduceret over en afstand på omkring 10, 000 km fra Østasien. Kredit:Franz Essl, Universitetet i Wien Rundt om på kloden, et stigen
Hvor langt rejser invasive arter?Den orange daglilje er en fremmed art i Centraleuropa og blev introduceret over en afstand på omkring 10, 000 km fra Østasien. Kredit:Franz Essl, Universitetet i Wien Rundt om på kloden, et stigen -
 Har prokaryoter cellevægge?Prokaryoter repræsenterer en af de to store klassifikationer i livet. De andre er eukaryoter . Prokaryoter er adskilt af deres lavere niveau af kompleksitet. De er alle mikroskopiske, skønt
Har prokaryoter cellevægge?Prokaryoter repræsenterer en af de to store klassifikationer i livet. De andre er eukaryoter . Prokaryoter er adskilt af deres lavere niveau af kompleksitet. De er alle mikroskopiske, skønt
- Boston Dynamics skræmmende robotvideoer:Er de rigtige?
- Små pakker til at teste store rumteknologiske fremskridt
- Ny proces fremmer området for kulstofudnyttelse
- Nyt videospil lærer teenagere om elektricitet
- Teoretisk gennembrud viser, at kvantevæsker roterer ved hjælp af proptrækkermekanisme
- Rejser til indkøb og fritidsaktiviteter forårsager mere luftforurening end pendling


