Strukturel indsigt i processer på DNA-skadesteder
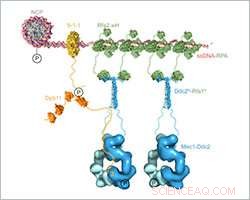
Til-skala sammensat strukturel model af Mec1-Ddc2-RPA-samlingen og aktivering på DNA-skadesteder. Kredit:Friedrich Miescher Institut for Biomedicinsk Forskning
Ishan Deshpande og hans kolleger fra gruppen af Susan Gasser og Protein Structure Facility på FMI belyste mekanismen for, hvordan Mec1-Ddc2, en tumorundertrykker involveret i DNA-skaderespons samles på steder med DNA-skade. De fokuserer på Ddc2-RPA-interaktionen, som bringer Mec1-Ddc2 kinasekomplekset til enkeltstrenget DNA på steder med DNA-skade. Med deres strukturelle data, FMI-forskerne giver det manglende led mellem to tidligere offentliggjorte strukturer, giver dem mulighed for at samle en sammensat strukturel model af Mec1-Ddc2 på ssDNA-RPA på DNA-skadesteder.
ATR-kinasen har tiltrukket sig interesse i over 20 år. Denne kinase er en af to centrale DNA-skaderegistrerende kinaser i pattedyrsceller, og det er også en tumor suppressor. To forbindelser, der hæmmer ATR-kinase, er i kliniske forsøg til behandling af leukæmi og solide tumorer. Endnu, hvordan dette enzym reguleres på et molekylært niveau, er forblevet uhåndgribeligt.
Ishan Deshpande, en ph.d.-studerende i proteinstrukturfaciliteten og gruppen af Susan Gasser ved Friedrich Miescher Institute for Biomedical Research (FMI), har nu belyst mekanismen for, hvordan gærhomologen af ATR, Mec1, samles på steder med DNA-skade til stedspecifik aktivering.
I gær, som hos mennesker, Mec1 danner et kompleks med en regulatorisk underenhed kaldet Ddc2 (ATRIP hos mennesker). Ved DNA-skader, store strækninger af enkeltstrenget DNA (ssDNA) eksponeres, som hurtigt dækkes af replikationsprotein A (RPA). Mec1-Ddc2 genkender disse ssDNA-RPA-strækninger og akkumuleres på disse steder for at igangsætte reparationsmekanismer.
Deshpande og kolleger har nu løst 3-D-strukturen af Ddc2 N-terminalen i forbindelse med en del af RPA, hvilket giver strukturelle data om forbindelsen mellem RPA og Mec1, som hidtil havde været uhåndgribelig. Vi opnåede en høj opløsning co-krystal struktur af Ddc2 N-terminalen sammen med en underenhed af RPA, Deshpande forklarede. Med disse data, vi kunne vise, at Ddc2 danner homodimerer og binder RPA ved sin N-terminal. Interessant nok, vores Ddc2-RPA-struktur er det manglende led mellem to tidligere offentliggjorte strukturer, og dette giver os mulighed for at samle en skala sammensat strukturel model af Mec1-Ddc2 på ssDNA-RPA på DNA-skadesteder.
Ddc2 N-terminalen letter ikke kun Mec1-interaktion med RPA, men fungerer også som en spacer for Mec1-kinasen. Deshpande forklarer:Den aflange Ddc2 N-terminal tillader det store Mec1 kinasemodul at bevæge sig uden at støde på det beskadigede DNA eller reparationsmaskineriet, der arbejder ved læsionen. Ud over, Ddc2 spaceren kan tillade Mec1 at phosphorylere flere rumligt adskilte substrater, mens den forbliver bundet til stedet for DNA-skade. Du kan tænke på Ddc2 N-terminalen som en girafs hals, der gør det muligt for giraffen at nå græsset på jorden såvel som bladene på et højt træ.
Korrekt Mec1-Ddc2 aktivitet er vigtig for alle former for DNA-skade reparation. Imidlertid, de funktionelle data fra Deshpande og kolleger indikerer, at Ddc2 N-terminalen er særlig vigtig for celleoverlevelse efter DNA-skade ved UV-lys. Vores model antyder, at den blotte rekruttering af Mec1-Ddc2 til ssDNA kan bidrage til dets homodimerisering og derfor aktivering af Mec1-Ddc2 komplekset, forklarer Deshpande.
Ud over, Susan Gasser påpeger "at dette har været et vidunderligt samarbejde mellem mit laboratorium og strukturfaciliteten i FMI, gør os i stand til at bygge bro fra struktur til funktion."
 Varme artikler
Varme artikler
-
 For meget karisma kan faktisk skade en leders effektivitetRonald Reagan, afbilledet her, mens han kæmpede for Californiens regeringsførelse, er ofte omtalt som en af de mere karismatiske moderne amerikanske ledere. Supportere når ud i dette billede fra 196
For meget karisma kan faktisk skade en leders effektivitetRonald Reagan, afbilledet her, mens han kæmpede for Californiens regeringsførelse, er ofte omtalt som en af de mere karismatiske moderne amerikanske ledere. Supportere når ud i dette billede fra 196 -
 Definitionen af kropssystemerDen menneskelige krop består af flere systemer, der arbejder sammen om at danne liv. Kropssystemer er en organiseret gruppe væv, der danner en bestemt funktion. Disse funktioner fungerer med andre
Definitionen af kropssystemerDen menneskelige krop består af flere systemer, der arbejder sammen om at danne liv. Kropssystemer er en organiseret gruppe væv, der danner en bestemt funktion. Disse funktioner fungerer med andre -
 Enheden kan redde havfugle fra farerne ved fiskeredskaberDen brasilianske håndstøbte Gianuca Projeto Albatroz. Kredit:Brasilien håndcastet Gianuca Projeto Albatroz En ny Dyrebeskyttelse Artikel, der opsummerer 4 års undersøgelse, viste, at en enhed ka
Enheden kan redde havfugle fra farerne ved fiskeredskaberDen brasilianske håndstøbte Gianuca Projeto Albatroz. Kredit:Brasilien håndcastet Gianuca Projeto Albatroz En ny Dyrebeskyttelse Artikel, der opsummerer 4 års undersøgelse, viste, at en enhed ka -
 Ny myrefugleart opdaget i PeruCordillera Azul-myrefuglen. Kredit:Andrew Spencer/Macaulay Library Det var den 10. juli, 2016, da Dan Lane, Fernando Angulo, Jesse Fagan, og jeg rullede ind i den kaffedyrkende by Flor de Café i d
Ny myrefugleart opdaget i PeruCordillera Azul-myrefuglen. Kredit:Andrew Spencer/Macaulay Library Det var den 10. juli, 2016, da Dan Lane, Fernando Angulo, Jesse Fagan, og jeg rullede ind i den kaffedyrkende by Flor de Café i d
- NASA-satellitter finder vindskydning, der påvirker orkanen Jose
- Forbedret frekvensfordobling tilføjer fotonikværktøjssættet
- Effektiviteten af stofmasker afhænger af typen af belægning
- En komplet platform til kvanteberegning
- Raiser regnen op eller sænker pollenantalet?
- Nanowire-målinger kan forbedre computerens hukommelse


