Enkeltmolekyle dissektion af udviklingsmæssig genkontrol
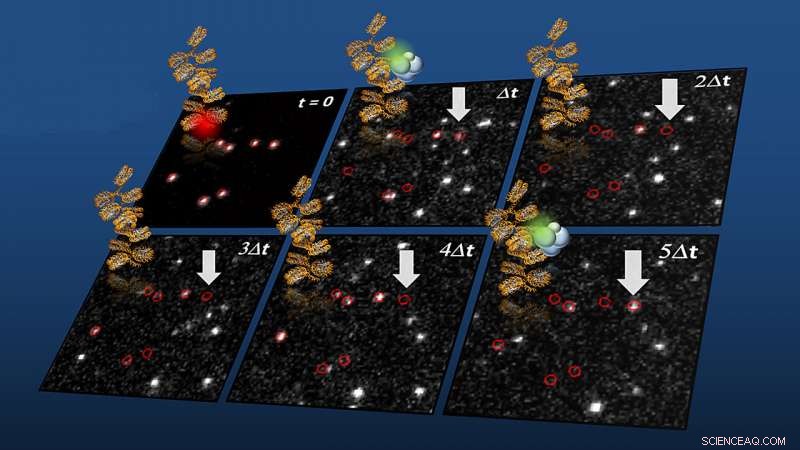
Enkeltmolekyldetektion af chromatininteraktionsdynamik for PRC2 (mærket med grønt) på kromatinfibre (mærket med rødt, t =0). Kredit:Beat Fierze/EPFL
Forskere ved EPFL og Max Plank har gjort betydelige opdagelser af, hvordan udviklingsgener styres af methyltransferase -enzymet PRC2. Undersøgelsen er offentliggjort i Natur Strukturel &Molekylær Biologi .
Polycomb repressive complex 2 (PRC2) er en del af et større system af proteiner, der arbejder sammen om at undertrykke ekspressionen af udviklingsgener. PRC2 gør dette ved at tilføje op til tre methylgrupper til en specifik lysinaminosyre (lysin 27) i histon H3 -proteinet. Trimethylering (tre methylgrupper) af lysin 27 er især vigtig, som slukker ekspressionen af specifikke gener under udvikling.
Sådan genundertrykkelse kræver en høj koncentration af lysin 27 trimethylering inden for definerede kromatin (DNA viklet omkring histoner) områder, da mutationer, der forhindrer denne proces, resulterer i udviklingsfejl eller kræft. For maksimal aktivitet, PRC2 har brug for yderligere "tilbehørsfaktorer", som varierer mellem arter. Hos mennesker, en hovedtilbehørsfaktor er PHF1.
Nu, laboratorier af Beat Fierz ved EPFL og Jürg Muller ved MPI kombineret kemisk biologi, biofysik, og strukturelle undersøgelser for at identificere den mekanisme, hvormed PHF1 øger aktiviteten af PRC2 -enzymet.
Forskerne brugte enkeltmolekylær fluorescensbilleddannelse til direkte at observere menneskelige PHF1-PRC2-komplekser, der interagerer med syntetiske kromatinfibre i realtid. Disse eksperimenter afslørede, at PHF1 -proteiner forankrer PRC2 på kromatin, øge deres lokale aktivitet.
Strukturel analyse viste, at PHF1 indeholder et tidligere ukendt DNA-bindende domæne, hvis interaktioner med det nukleosomale DNA er afgørende for forankring af PRC2 til kromatin og for at øge dets aktivitet. I det væsentlige, dette DNA-bindende domæne er nøglen til effektiv genregulering på tværs af forskellige arter. Som forfatterne skriver:"... en væsentlig del af bindingsaffiniteten af PRC2 for nukleosomer stammer fra interaktioner mellem komplekset og DNA."
Forfatterne drager tre konklusioner af resultaterne:For det første, at PRC2's bindingsaffinitet for chromatinsubstrat bestemmes af dets interaktioner med DNA. Sekund, at øget forankring af PRC2 til kromatin via PHF1 afhænger af en nyligt identificeret strukturel enhed i PHF1. Og for det tredje, at stabile PRC2 -kromatininteraktioner, medieret af PHF1, er nøglen til øget lysintrimethylering i kromatin - og dermed til genrepression.
"Vi er begejstrede for evnen til at kombinere kemi og billeddannelse til at observere grundlæggende molekylære processer på enkeltmolekylskalaen og i realtid, "siger Beat Fierz." Disse fremgangsmåder giver virkelig nye veje til at forstå biologi med kemisk præcision, som vist her for PRC2-afhængig genregulering. "
 Varme artikler
Varme artikler
-
 Hurtigere salmonellatest øger fødevaresikkerheden for mennesker og dyrSalmonella danner en biofilm. Kredit:CDC En ny test tillader præcis, hurtig test for Salmonella , en bakterie, der er en af de førende årsager til fødevarebåren sygdom i alle regioner i verden
Hurtigere salmonellatest øger fødevaresikkerheden for mennesker og dyrSalmonella danner en biofilm. Kredit:CDC En ny test tillader præcis, hurtig test for Salmonella , en bakterie, der er en af de førende årsager til fødevarebåren sygdom i alle regioner i verden -
 Venstrehåndsfisk og asymmetriske hjernerCichlider af Perissodus microlepis-arten endemisk til Tanganyika-søen i Afrika. Kredit:Universitetet i Konstanz Til mennesker, at være højrehåndet eller venstrehåndet spiller en vigtig rolle. De f
Venstrehåndsfisk og asymmetriske hjernerCichlider af Perissodus microlepis-arten endemisk til Tanganyika-søen i Afrika. Kredit:Universitetet i Konstanz Til mennesker, at være højrehåndet eller venstrehåndet spiller en vigtig rolle. De f -
 Pizza mareridt:Kan din kost bestemme dine drømme?Tilbage i 1937, da Porky Pig blev kaldt Piggy Hamhock, han lærte en værdifuld lektion om at spise sent på aftenen. Warner Bros Hvis du nogensinde har haft kødelskere, fyldt skorpe pizza inden sengeti
Pizza mareridt:Kan din kost bestemme dine drømme?Tilbage i 1937, da Porky Pig blev kaldt Piggy Hamhock, han lærte en værdifuld lektion om at spise sent på aftenen. Warner Bros Hvis du nogensinde har haft kødelskere, fyldt skorpe pizza inden sengeti -
 Forskellene i broderlige og faderlige tvillingerDer er generelt to typer tvillinger: broderskab og identiske. Identiske tvillinger kaldes undertiden faderlige eller mødre tvillinger, men dette er ikke-videnskabelige udtryk og betyder simpelthen, at
Forskellene i broderlige og faderlige tvillingerDer er generelt to typer tvillinger: broderskab og identiske. Identiske tvillinger kaldes undertiden faderlige eller mødre tvillinger, men dette er ikke-videnskabelige udtryk og betyder simpelthen, at
- Mysteriet om deltids-pulsarer
- Tokyo-området lukker ned, da kraftig tyfon slår Japan (Opdatering)
- Toyota advarer om, at Brexit uden aftale vil stoppe produktionen på fabrikken i Storbritannien
- Dine Facebook-venner mener det ikke, men de skader dig sandsynligvis dagligt:studie
- Perihelion og Aphelion
- Bebyggelse med blandet anvendelse kan faktisk reducere boligoverkommeligheden, social mangfoldighed


