Ny cellefri proteinkrystalliseringsmetode til fremme af strukturbiologi
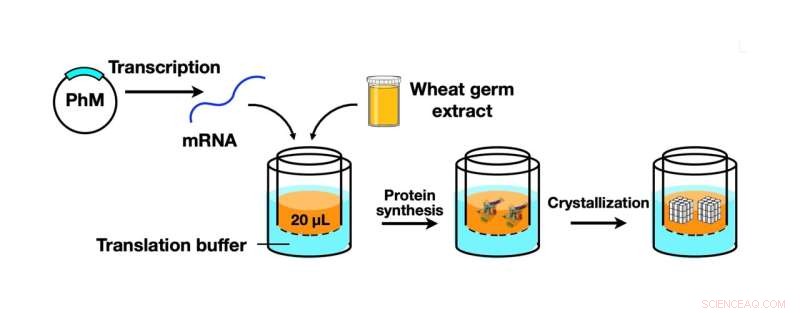
Skematisk illustration af CFPC-proces ved anvendelse af et hvedekimproteinsyntesesæt til at syntetisere polyhedrinmonomer (PhM), som blev yderligere krystalliseret til polyederkrystaller i nanostørrelse. Kredit:Prof. Takafumi Ueno
Den nye cellefri proteinkrystallisationsmetode (CFPC) udviklet af Tokyo Tech omfatter direkte proteinkrystallisering og er et stort fremskridt inden for strukturbiologi. Denne teknik vil muliggøre analyse af ustabile proteiner, der ikke kunne studeres ved hjælp af konventionelle metoder. At analysere disse vil øge vores viden om cellulære processer og funktioner.
Mens vi er bekendt med visse krystaller som salt og sukker, som vi bruger i vores hverdag, er der et andet sæt krystaller, skjult for det blotte øje, som er afgørende for vores biologi. Mikroskopiske proteinkrystaller findes i levende celler og hjælper med at opretholde processer som immunsystemaktivering, proteinlagring og beskyttelse.
For bedre at forstå forholdet mellem proteinkrystallers struktur og funktion udviklede forskere metoden in-cell protein crystallization (ICPC), som direkte kan observere proteinkrystaller i levende celler, hvilket sikrer krystaller af høj kvalitet uden behov for oprensningsprocesser eller kompleks screening metoder. Men på trods af dets mange fordele blev der rapporteret meget få strukturer, fordi krystallerne dannet i levende celler ikke havde den størrelse og kvalitet, der var påkrævet til analyse. Så et team af forskere fra Japan, ledet af prof. Takafumi Ueno fra Tokyo Tech havde til formål at udvikle en bedre metode. Og for nylig fik de et gennembrud.
I deres artikel offentliggjort i Scientific Reports , rapporterede holdet udviklingen af en teknik, der ville gøre proteinkrystallisering og analyse mere effektiv og effektiv. Denne teknik – en cellefri proteinkrystallisationsmetode (CFPC) – var en hybrid mellem in vitro proteinkrystallisation og ICPC og tillod hurtig og direkte dannelse af proteinkrystaller uden behov for komplicerede krystalliserings- og oprensningsmetoder.
Scanningelektronmikroskopibilleder og størrelsesfordelingshistogrammer af polyederkrystaller (PhC'er) viser forskellige punkter i den tidsafhængige CFPC-proces. Kredit:Prof. Takafumi Ueno
For at vende tilbage til holdet, der udfører den aktuelle undersøgelse (hvoraf nogle også er medlemmer af Ueno Laboratory), brugte de et hvedekimproteinsyntesesæt, som er et værktøj til syntese af polyhedrinmonomer, et viralt protein produceret i insektceller af cypovirus infektion. Dette protein blev derefter krystalliseret ved hjælp af den nye CFPC-metode, hvilket førte til dannelsen af nano-størrelse polyhedra krystaller (PhC'er). Holdet kunne effektivt fuldføre denne proces inden for seks timer ved kun at bruge 20 mikroliter af reaktionsblandingen.
Scanningelektronmikroskopibilleder indikerede, at PhC'erne havde fremragende renhed, hvilket gjorde det muligt at bestemme deres struktur ved en opløsning så høj som 1,95 Å (eller 1,95 ångstrøm). For yderligere at udforske mulighederne i deres nye system, udførte holdet den strukturelle analyse af krystallinsk inklusionsprotein A (CipA). Dens struktur blev bestemt ved en høj opløsning på 2,11 Å, noget der aldrig var blevet rapporteret før denne undersøgelse.
Dette arbejde er et stort spring fremad inden for strukturbiologi, da den foreslåede metode vil muliggøre analyse af ustabile proteiner med lavt udbytte, som ikke kan studeres med konventionelle metoder. Denne teknologi har også til formål at hjælpe med udviklingen af avancerede teknikker til småskala og hurtig proteinkrystallisering og analyse. "De proteinkrystaller af høj kvalitet, der produceres af vores metode, vil udvide horisonten for strukturel bestemmelse og give os nyttig og hidtil uset indsigt i det komplekse miljø af levende celler," siger prof Ueno. + Udforsk yderligere
In-celle nano-3D-printer:Syntetisering af stabile filamenter fra in-celle proteinkrystaller
Sidste artikelEn bedre måde at finde RNA-virusnåle i databasehøstakke
Næste artikelHvordan en molekylær switch former planteorganvækst
 Varme artikler
Varme artikler
-
 Opdaget? Ny, men uddød menneskelig slægtning fra MelanesiaForskere, der gennemkæmpede DNA fra nutidens mennesker fra Melanesia, fandt ud af, at melaneserne havde mindre neandertaler- og denisovansk DNA end man troede, tyder på, at en tredje, separat gruppe a
Opdaget? Ny, men uddød menneskelig slægtning fra MelanesiaForskere, der gennemkæmpede DNA fra nutidens mennesker fra Melanesia, fandt ud af, at melaneserne havde mindre neandertaler- og denisovansk DNA end man troede, tyder på, at en tredje, separat gruppe a -
 Ny forskning identificerer mangel på passende kontrolværktøjer til mange større infektionssygdom…Kredit:Pixabay/CC0 Public Domain Ny forskning offentliggjort i The Lancet Planetary Health har identificeret en mangel på passende kontrolværktøjer for mange infektionssygdomme hos dyr, som kan hav
Ny forskning identificerer mangel på passende kontrolværktøjer til mange større infektionssygdom…Kredit:Pixabay/CC0 Public Domain Ny forskning offentliggjort i The Lancet Planetary Health har identificeret en mangel på passende kontrolværktøjer for mange infektionssygdomme hos dyr, som kan hav -
 Vandmænd på menuenKredit:University of East Anglia Blæksprutte, eneste, hundehat, sild og torsk lever alle af babyvandmænd – ifølge ny forskning fra University of East Anglia og Center for Environment, Fiskeri- og
Vandmænd på menuenKredit:University of East Anglia Blæksprutte, eneste, hundehat, sild og torsk lever alle af babyvandmænd – ifølge ny forskning fra University of East Anglia og Center for Environment, Fiskeri- og -
 Hvorfor har planteceller cellevægge såvel som cellemembraner?Alle celler har cellemembraner, der regulerer indtræden og udgangen af opløste stoffer. I modsætning til dyreceller har planteceller imidlertid også en cellevæg, der omgiver cellemembranen. Cellevæg
Hvorfor har planteceller cellevægge såvel som cellemembraner?Alle celler har cellemembraner, der regulerer indtræden og udgangen af opløste stoffer. I modsætning til dyreceller har planteceller imidlertid også en cellevæg, der omgiver cellemembranen. Cellevæg


