Et enkelt protein kontrollerer aldringssignaler mere effektivt end i et team
Kredit:University of Cologne
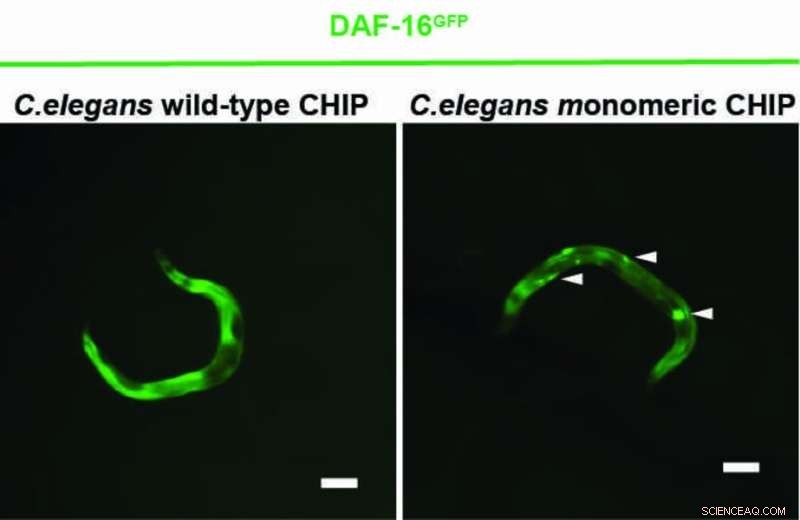
En ny undersøgelse viser, at proteinet CHIP kan regulere insulinreceptoren mere effektivt alene end i en parret tilstand. I cellulære stresssituationer optræder CHIP sædvanligvis som en homodimer - en forening af to identiske proteiner - og tjener primært til at nedbryde fejlfoldede og defekte proteiner. CHIP renser således op i cellen. Til dette formål samarbejder CHIP med hjælpeproteiner for at binde en kæde af det lille protein ubiquitin til fejlfoldede proteiner. De defekte proteiner genkendes og elimineres således af cellen. Derudover regulerer CHIP også signaltransduktionen af insulinreceptoren. CHIP binder ubiquitin til receptoren for at nedbryde den og stoppe aktiveringen af livsforlængende genprodukter.
Et Køln-baseret forskerhold ledet af prof Dr. Thorsten Hoppe har nu i forsøg med nematoden Caenorhabditis elegans og menneskeceller vist, at CHIP også kan mærke sig selv med ubiquitin, som forhindrer dannelsen af dimer. CHIP-monomeren er mere effektiv end CHIP-dimeren til at regulere insulinsignalering. Studiet fra University of Cologne's Cluster of Excellence for Cellular Stress Responses in Aging-Associated Diseases (CECAD) blev offentliggjort i Molecular Cell under titlen "En dimer-monomer-switch styrer CHIP-afhængig substratubiquitylering og -behandling."
"Om CHIP virker alene eller som et par afhænger af cellens tilstand. Under stress er der for mange fejlfoldede proteiner samt hjælpeproteinerne, der binder til CHIP og forhindrer auto-ubiquitylering, selvmærkningen med ubiquitin." sagde Vishnu Balaji, første forfatter af undersøgelsen.
"Efter at CHIP med succes har renset de defekte proteiner, kan det også markere hjælperproteinerne for nedbrydning. Dette gør det muligt for CHIP at allestedsnærværende og fungere som en monomer igen," forklarede han. For at kroppen kan fungere glat, skal der således være en balance mellem de monomere og dimere tilstande af CHIP.
"Det er interessant, at monomer-dimer-balancen i CHIP ser ud til at være forstyrret i neurodegenerative sygdomme," sagde Thorsten Hoppe. "I spinocerebellære ataksier, for eksempel, muteres forskellige steder af CHIP, og det fungerer overvejende som en dimer. Her ville et skift til flere monomerer være en mulig terapeutisk tilgang."
I næste trin vil forskerne finde ud af, om der er andre proteiner eller receptorer, som CHIP-monomeren binder sig til og dermed regulerer deres funktion. Forskerne er også interesserede i at finde ud af, i hvilke væv og organer og i hvilke sygdomme CHIP monomerer eller dimerer forekommer i større antal, for i fremtiden at kunne udvikle mere målrettede terapier. + Udforsk yderligere
Sammenhængen mellem proteinaggregering og aldring
 Varme artikler
Varme artikler
-
 Obligatorisk mærkning af gensplejsede fødevarer kan reducere kundernes købKredit:Scott Warman på Unsplash Etiketter, der advarer kunder om, at produkter indeholder ingredienser fra gensplejsede planter, kan reducere salget, i det mindste på kort sigt, ifølge en ny unders
Obligatorisk mærkning af gensplejsede fødevarer kan reducere kundernes købKredit:Scott Warman på Unsplash Etiketter, der advarer kunder om, at produkter indeholder ingredienser fra gensplejsede planter, kan reducere salget, i det mindste på kort sigt, ifølge en ny unders -
 Kunstige reder har til formål at øge Shy Albatross ynglesuccesEt par generte albatrosser (Thalassarche cauta) genforenes til ynglesæsonen og engagerer sig i frieriritualer, Albatross Island, juni 2017. Kredit:Matthew Newton / WWF-Aus Specialbyggede mudderste
Kunstige reder har til formål at øge Shy Albatross ynglesuccesEt par generte albatrosser (Thalassarche cauta) genforenes til ynglesæsonen og engagerer sig i frieriritualer, Albatross Island, juni 2017. Kredit:Matthew Newton / WWF-Aus Specialbyggede mudderste -
 Forskere udforsker lampretters evne til at tilpasse sig og overleveMunden af en havlampret, Petromyzon marinus. Kredit:Drow male/CC BY-SA 3.0, via Wikipedia. Evnen til at regulere salt- og vandbalancen er en betydelig udfordring for dyr, der lever i ferskvandsha
Forskere udforsker lampretters evne til at tilpasse sig og overleveMunden af en havlampret, Petromyzon marinus. Kredit:Drow male/CC BY-SA 3.0, via Wikipedia. Evnen til at regulere salt- og vandbalancen er en betydelig udfordring for dyr, der lever i ferskvandsha -
 Æsler har brug for mere beskyttelse mod vinteren end hesteÆsler er ikke så i stand til at holde varmen i Storbritanniens kulde, fugtige vintre. Kredit:University of Portsmouth Æsler er ikke så i stand til at holde varmen som heste i Storbritanniens kulde
Æsler har brug for mere beskyttelse mod vinteren end hesteÆsler er ikke så i stand til at holde varmen i Storbritanniens kulde, fugtige vintre. Kredit:University of Portsmouth Æsler er ikke så i stand til at holde varmen som heste i Storbritanniens kulde
- NASA-billeder afslører de stærkeste områder af Tropical Storm Beta
- Eksperter:Uber SUV'ers autonome system burde have set en kvinde
- Avanceret fingeraftryksteknologi kan hjælpe i kampen mod knivkriminalitet
- Miljøforurening forårsaget af fabrikker
- Resultater fra NEOS -eksperimentet på sterile neutrinoer adskiller sig delvis fra de teoretiske for…
- Gør negative meninger behagelige:Undersøgelse finder, at social deling sker i form af støtte


