Ikke kun en sikkerhedskopi – den dobbelte specificitet af UBA6
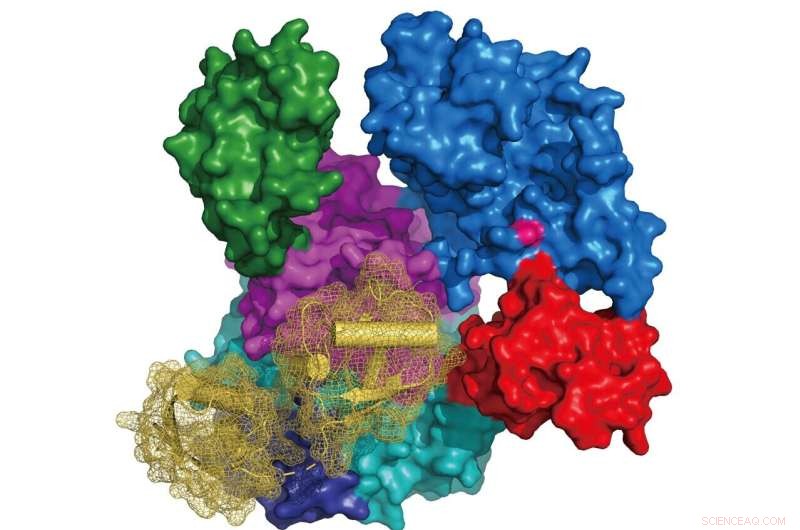
Billede:Struktur af UBA6 (overfladerepræsentation farvet i henhold til dets domænearkitektur, aktivt site cystein i pink) i kompleks med FAT10 (bånddiagram i gult med overfladerepræsentation i mesh). Kredit:Schindelin Group
Forskere ved Rudolf Virchow Center ved University of Würzburg har afsløret krystalstrukturerne af UBA6 i kompleks med enten ATP eller det ubiquitin-lignende protein FAT10. Disse resultater danner grundlaget for at studere de individuelle roller af UBA6 i retning af vedhæftning af enten ubiquitin eller FAT10 til målproteiner og de nedstrøms cellulære veje med mulige implikationer for ætiologien af visse tumorer. Denne undersøgelse blev offentliggjort i tidsskriftet Nature Communications .
Ubiquitylering af målproteiner er en af de vigtigste post-translationelle modifikationer og spiller væsentlige roller i adskillige cellulære processer. Ubiquitylering udføres af en sekventiel enzymatisk kaskade af E1-aktiverende enzymer, E2-konjugerende enzymer og E3-ligerende enzymer. I mange år blev UBA1 anset for at være det eneste E1-enzym, der aktiverer ubiquitin, indtil der i 2007 blev opdaget et andet ubiquitinaktiverende enzym:UBA6.
Et potentielt mål for lægemiddeludvikling
UBA6 er kun til stede i hvirveldyr og søpindsvin. Spændende nok er UBA6 et usædvanligt E1-enzym, da det aktiverer både ubiquitin og det ubiquitin-lignende protein (Ubl) FAT10. På grund af dens begrænsede række af ubiquityleringshændelser sammenlignet med virkningen af det generiske ubiquitinaktiverende enzym UBA1 og er den eneste E1-katalyserende FAT10-binding, anses UBA6 for at være et potentielt lægemiddelmål. For yderligere at udforske den målrettede hæmning af UAB6 er det vigtigt at forstå dets dobbelte specificitet og identificere varianter af enzymet, som er svækket i enten ubiquitin- eller FAT10-aktivering.
Forskergruppen af Prof. Hermann Schindelin ved Rudolf Virchow Center ved University of Würzburg rapporterer de første strukturer af UBA6, i kompleks med enten ATP eller FAT10. Interessant nok afslørede deres struktur- og modelleringsstudier også, hvordan UBA6 tillader dobbelt genkendelse af ubiquitin og FAT10. Et andet nøglefund er identifikation af UBA6-varianter, som selektivt afskaffer aktiveringen af enten ubiquitin eller FAT10. "Disse resultater danner grundlaget for at studere de individuelle roller, UBA6 spiller i aktiveringen af enten ubiquitin eller FAT10 i nedstrøms cellulære veje," siger Schindelin.
Viklet ind i forskellige sygdomme
Da ubiquitylering og FAT10ylering er involveret i flere cellulære processer, er det ikke overraskende, at funktionsfejl i en eller flere komponenter i dette system fører til en række forskellige sygdomme. UBA6-medieret proteasomal nedbrydning blev rapporteret at være involveret i hjerne-associerede fysiologiske og patofysiologiske tilstande hos mus. Interessant nok blev UBA6 fundet at være overudtrykt i menneskelige hjerner fra patienter med Alzheimers sygdom. Tumorsuppressorproteinet p53 er et FAT10-substrat, og en dobbeltnegativ regulering af FAT10 og p53 blev observeret at være kritisk i kontrollen af tumorgenese, hvilket er på linje med overekspressionen af FAT10 i mange cancercelletyper.
Mens forudsigelser vedrørende orienteringen af ubiquitin i kompleks med UBA6 let kunne genereres på basis af UBA6-ATP komplekse struktur og tilgængelige UBA1-Ub strukturer, syntes det umuligt at forudsige, hvordan FAT10 og især dets N-terminale domæne ( NTD) ville interagere med UBA6. Derfor var bestemmelsen af UBA6-FAT10 co-krystalstrukturen et afgørende skridt. Baseret på de eksperimentelt afledte strukturer og modellen UBA6-ubiquitin-kompleks blev der identificeret en selektivitetsswitch, som førte til, at den efterfølgende opdagelse af UBA6-varianter selektivt afskaffede aktiveringen af begge modifikatorer.
Fremtidige undersøgelser af UBA6 med de selektivt svækkede mutanter er nødvendige for at undersøge mulige forbindelser mellem UBA6-katalyseret ubiquitylering og FAT10ylering i forbindelse med cancer. "Hvis årsagssammenhænge kan etableres, vil den målrettede hæmning af UBA6 ved hjælp af enzymatiske og i silico-baserede screeningstilgange blive udført," forklarer Schindelin. "Med sættet af mutaner, som selektivt hæmmer ubiquitylering eller FAT10ylering, vil vi undersøge den selektive svækkelse af begge processer i cellebaserede eksperimenter med et særligt fokus på kræftceller." + Udforsk yderligere
Team analyserer med succes strukturen af proteinet FAT10 mod potentiel cancerterapi
 Varme artikler
Varme artikler
-
 Forskere skaber endocytose efter behov ved hjælp af hotwiring-cellerDe pinky-lilla pletter er de endocytiske vesikler, der er lavet af den varme ledningsproces. Kredit:Gabrielle Larocque En løsning på problemet med at skabe endocytose efter behov sammenlignes med
Forskere skaber endocytose efter behov ved hjælp af hotwiring-cellerDe pinky-lilla pletter er de endocytiske vesikler, der er lavet af den varme ledningsproces. Kredit:Gabrielle Larocque En løsning på problemet med at skabe endocytose efter behov sammenlignes med -
 Selv vilde pattedyr har regionale dialekterKredit:Cardiff University Forskere fra Cardiff Universitys Otter Project har opdaget, at genetisk adskilte populationer af vilde oddere fra hele Storbritannien har deres egne regionale lugte til a
Selv vilde pattedyr har regionale dialekterKredit:Cardiff University Forskere fra Cardiff Universitys Otter Project har opdaget, at genetisk adskilte populationer af vilde oddere fra hele Storbritannien har deres egne regionale lugte til a -
 Spor af historisk rensdyrgræsning kan stadig iagttages efter 100 årEn typisk historisk malkeplads i Padjelanta, Sverige. Kredit:Dagmar Egelkraut Med feriesæsonen om hjørnet, de fleste mennesker tænker måske først på rensdyr som julemandens betroede hjælpere. Men
Spor af historisk rensdyrgræsning kan stadig iagttages efter 100 årEn typisk historisk malkeplads i Padjelanta, Sverige. Kredit:Dagmar Egelkraut Med feriesæsonen om hjørnet, de fleste mennesker tænker måske først på rensdyr som julemandens betroede hjælpere. Men -
 Fra dråbe til opdagelseAxin- og APC-proteiner danner en dråbe omkring centrosomet, hvilket skaber et reaktionskammer fra Wnt-vejen. Kredit:Matt Perko Stamceller flyder over med potentiale. Deres evne til at blive andre c
Fra dråbe til opdagelseAxin- og APC-proteiner danner en dråbe omkring centrosomet, hvilket skaber et reaktionskammer fra Wnt-vejen. Kredit:Matt Perko Stamceller flyder over med potentiale. Deres evne til at blive andre c
- Sådan læses godt vandtestresultater
- Molière skrev højst sandsynligt sine egne skuespil
- Ny undersøgelse foreslår en lav pris, højeffektiv maskedesign
- Ferskvand kan være nøglen til håndtering af Lake Os giftige alger, undersøgelse finder
- Hvordan århundreders selvisolation gjorde Japan til et af de mest bæredygtige samfund på jorden
- Forstå høj effektivitet af dybe ultraviolette lysdioder


