Forskere optrævler krystalstrukturen af et nøgleenzym af SARS-CoV-2, hvilket baner vejen for nye antivirale midler
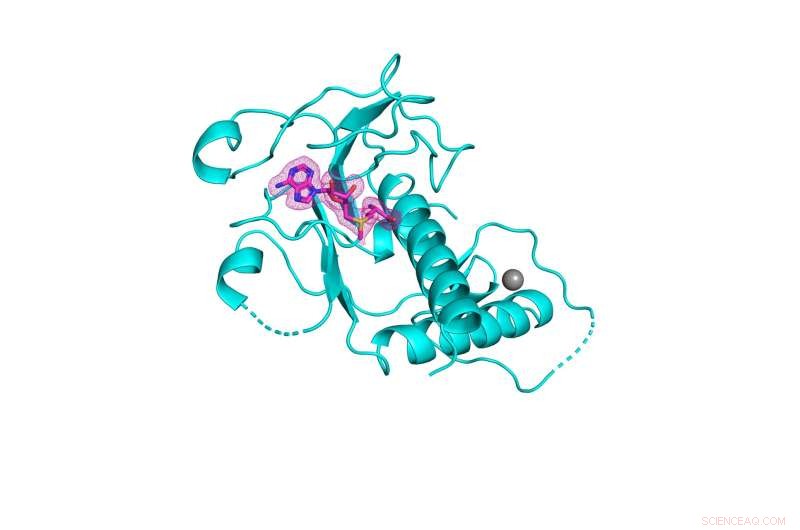
3-D struktur af SARS-CoV-2 nsp14 methyltransferase domæne (vist i cyan) bundet til dets naturlige cofaktor S-adenosylmethionin (vist i pink mesh). Kredit:Kottur, et al; Naturens strukturelle og molekylære biologi
Et hold af Mount Sinai-forskere har produceret en højopløselig krystalstruktur af et enzym, der er afgørende for overlevelsen af SARS-CoV-2, den virus, der forårsager COVID-19. Opdagelsen kan føre til design af kritisk nødvendige nye antivirale midler til at bekæmpe nuværende og fremtidige coronavirus.
Enzymet, kendt som nsp14, har en afgørende vigtig region kendt som RNA-methyltransferase-domænet, som har unddraget sig tidligere forsøg fra det videnskabelige samfund på at karakterisere dets tredimensionelle krystalstruktur. Et papir, der beskriver den innovative proces, blev offentliggjort i onlineudgaven af Nature Structural &Molecular Biology den 8. september .
"At være i stand til at visualisere formen af methyltransferase-domænet af nsp14 i høj opløsning giver os indsigt i, hvordan man designer små molekyler, der passer ind i dets aktive sted, og dermed hæmmer dets væsentlige kemi," siger seniorforfatter Aneel Aggarwal, Ph.D. , professor i farmakologiske videnskaber ved Icahn School of Medicine ved Sinai-bjerget. "Med denne strukturelle information og i samarbejde med medicinske kemikere og virologer kan vi nu designe små molekylehæmmere til at tilføje til familien af antivirale midler, der går hånd i hånd med vacciner til bekæmpelse af SARS-CoV-2."
Receptpligtige antivirale midler, der retter sig mod nøgleenzymer af SARS-CoV-2, omfatter nirmatrelvir til hovedproteasen (M Pro ) enzym og molnupiravir og remdesivir for RNA-polymerase (nsp12) enzymet. Forskningen for at udvikle nye antivirale midler rettet mod forskellige enzymatiske aktiviteter har været accelererende i laboratorier rundt om i verden, og Mount Sinais opdagelse har bidraget væsentligt til denne indsats.
"En del af det, der driver vores arbejde," siger Dr. Aggarwal, "er den viden, man opnår ved at behandle HIV - at man typisk har brug for en cocktail af inhibitorer for at opnå maksimal effekt mod virussen."
Mount Sinai-teamet udviklede faktisk tre krystalstrukturer af nsp14, hver med forskellige cofaktorer, hvorfra de identificerede det bedste stillads til design af antivirale midler til inhibering af RNA-methyltransferaseaktiviteten, som enzymet muliggør, og som virussen har brug for for at overleve. Ifølge deres skema ville det antivirale middel træde i stedet for den naturlige cofaktor S-adenosylmethionin og dermed forhindre methyltransferase-kemien i at opstå. De krystalstrukturer, som holdet har belyst, er blevet gjort tilgængelige for offentligheden og vil nu tjene som guider for biokemikere og virologer globalt til at konstruere disse forbindelser.
At gøre opdagelsen mulig var forskernes evne til at rydde en forhindring, der havde forhindret andre i fortiden i at skabe tredimensionelle krystaller af nsp14-methytransferase-domænet. "Vi brugte en tilgang kendt som fusionsassisteret krystallisering," forklarer hovedforfatter Jithesh Kottur, Ph.D., en postdoc ved Icahn Mount Sinai og en krystallograf og biokemiker. "Det involverer at fusionere enzymet med et andet lille protein, der hjælper det med at krystallisere."
Dr. Aggarwal, en internationalt anerkendt strukturbiolog, understreger vigtigheden af igangværende efterforskningsarbejde af forskere inden for hans felt mod en virus, der har ført til millioner af dødsfald globalt. "Virusen udvikler sig så hurtigt, at den kan udvikle resistens over for de antivirale midler, der nu er tilgængelige, og derfor er vi nødt til at fortsætte med at udvikle nye," bemærker han. "På grund af den høje sekvensbevarelse af nsp14 på tværs af coronavirus og deres varianter (hvilket betyder, at den ikke muterer meget), vil vores undersøgelse hjælpe med design af bredspektrede antivirale midler til både nuværende og fremtidige coronavirusudbrud." + Udforsk yderligere
Ny undersøgelse opdager den tredimensionelle struktur af genomreplikationsmaskinen
 Varme artikler
Varme artikler
-
 Skjuler sig ved almindeligt syn - Opdagelse rejser spørgsmål om omfanget af overset biodiversitetTo arter, som forskere har vist, er genetisk divergerende, Meladema coriacea (til venstre) og Meladema lepidoptera (ret). Kredit:David Bilton - University of Plymouth Forskere har brugt avance
Skjuler sig ved almindeligt syn - Opdagelse rejser spørgsmål om omfanget af overset biodiversitetTo arter, som forskere har vist, er genetisk divergerende, Meladema coriacea (til venstre) og Meladema lepidoptera (ret). Kredit:David Bilton - University of Plymouth Forskere har brugt avance -
 Metoden giver forskere mulighed for at indsamle kropslugtprøver af pattedyr på en ikke-invasiv må…Blandt andre muligheder, pattedyr, som surikater, bruge olfaktoriske signaler til at kommunikere med artsfæller. Kredit:Brigitte Schlögl (geb. Weiß) Pattedyr kommunikerer med hinanden ved hjælp af
Metoden giver forskere mulighed for at indsamle kropslugtprøver af pattedyr på en ikke-invasiv må…Blandt andre muligheder, pattedyr, som surikater, bruge olfaktoriske signaler til at kommunikere med artsfæller. Kredit:Brigitte Schlögl (geb. Weiß) Pattedyr kommunikerer med hinanden ved hjælp af -
 Tsunami afslører menneskelig støjforurening i hawaiianske farvandeEn af havbundens dataloggere, der blev brugt til at optage undervandslyd i en ny undersøgelse af menneskelig interaktion med spinnerdelfiner på Hawaii. Kredit:Duke University En tsunami, der ramte
Tsunami afslører menneskelig støjforurening i hawaiianske farvandeEn af havbundens dataloggere, der blev brugt til at optage undervandslyd i en ny undersøgelse af menneskelig interaktion med spinnerdelfiner på Hawaii. Kredit:Duke University En tsunami, der ramte -
 Ny måde at forhindre gensplejsede og uændrede organismer i at producere afkomEn væsentlig hindring for at anvende genteknologi til gavn for mennesker og miljø er risikoen for, at organismer, hvis gener er blevet ændret, kan få afkom med deres naturlige modstykker, frigivelse a
Ny måde at forhindre gensplejsede og uændrede organismer i at producere afkomEn væsentlig hindring for at anvende genteknologi til gavn for mennesker og miljø er risikoen for, at organismer, hvis gener er blevet ændret, kan få afkom med deres naturlige modstykker, frigivelse a
- Hvorfor julis fuldmåne er kendt som bukkemånen
- Alaska-hedebølgen knuser byens rekord, forstyrrer job og liv
- Satellitdata til landbruget
- S.Afrika løfter katastrofe på grund af tørke
- Magt til folket:Hvordan hverdagslige trodshandlinger kan forme og ændre markeder
- Galakse-skala springvand set i fuld pragt


