Forskere beskriver en vigtig komponent i kroppens energiforsyningsmekanisme
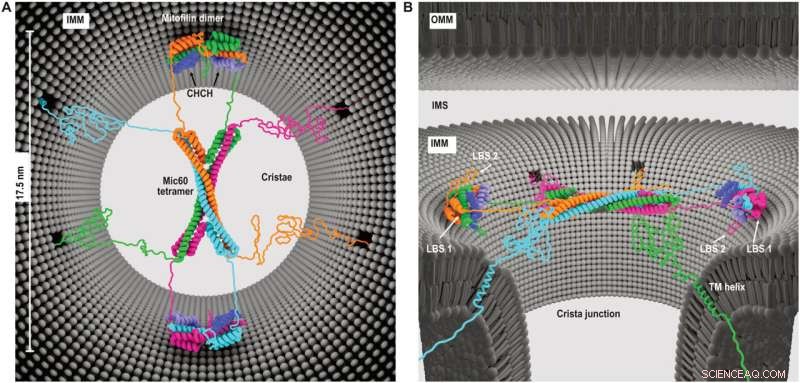
Model af Mic60-Mic19 funktion på CJs. (A) Set ovenfra og (B) set fra siden, der viser den foreslåede arkitektur af Mic60-Mic19 komplekset ved CJs. Hver monomer har en anden farve. Regioner, der ikke er bestemt af røntgenkrystallografi, modelleres som ustrukturerede elementer. Kredit:Science Advances (2022). DOI:10.1126/sciadv.abo4946
Inden for mitokondrierne forekommer komplekse biokemiske processer, der omdanner energien i de kulhydrater, som vi spiser, til det vigtige energiopbevarende molekyle ATP (adenosintrifosfat). ATP er i bund og grund det "brændstof", der driver alle processer i levende celler. Hvis ATP-produktionen af en eller anden grund hæmmes, kan der være alvorlige konsekvenser for den menneskelige krop, herunder alvorlig sygdom og død.
De områder i mitokondrierne, hvor ATP-syntese finder sted, er kendt som cristae, som er foldede fremspring på den indre mitokondriemembran. "Cristae huser molekylære maskiner, der fungerer som turbiner og bruger den kontrollerede strøm af brintioner til at drive ATP-syntese," forklarede Martin van de Laan, professor i medicinsk biokemi ved Saarland University. "Denne elegante mekanisme kan kun fungere, hvis mitokondriernes indre fine struktur og dannelsen af cristae konstant opretholdes," tilføjede prof. van der Laan.
I samarbejde med sit team og med kolleger fra Max Delbrück Center for Molekylær Medicin i Berlin har van der Laan været i stand til at opnå indsigt i den molekylære struktur af en stor og kompleks stilladslignende proteinsamling, der spiller en vigtig rolle i styringen af cristae-arkitekturen . Deres resultater er nu blevet offentliggjort iScience Advances .
Denne molekylære enhed, kendt som Mitochondrial Contact Site and Cristae Organizing System (MICOS), fungerer effektivt som indgangsporten til cristae-rummene. MICOS-proteinunderenhederne Mic60 og Mic19 har begge membranformende egenskaber og sammen fungerer de som en "dørmand", der kun tillader udvalgte molekyler at komme ind eller ud af det indre af cristae.
Forskerholdet har nu vist, hvordan MICOS-komponenterne Mic60 og Mic19 danner filamentøse bundter, der kan samle sig selv og danne en hvælvet molekylær struktur, der spænder over indgangen til cristae. "Denne kuppellignende samling er elastisk bundet til mitokondriemembranerne," forklarede professor van der Laan. "Designet og arkitekturen af MICOS giver os vigtig indsigt i, hvordan MICOS kan fungere som en fleksibel, men kontrollerbar gateway til cristae og dermed regulere mitokondriel energimetabolisme."
Dette gennembrud var muligt takket være det tætte samarbejde mellem de to deltagende forskergrupper, som med succes var i stand til at kombinere data fra den strukturelle belysning af oprensede og krystalliserede MICOS-fragmenter med resultaterne af målrettede funktionelle analyser af genetisk modificerede MICOS-varianter i levende celler.
Disse banebrydende nye resultater har banet vejen for yderligere tværfaglig forskning om dette spændende emne. Opfølgningsstudierne vil undersøge og analysere den hvælvingslignende struktur, der nu er blevet identificeret, for at bestemme dens betydning for cristaes struktur og funktion og for mitokondrie energimetabolisme. Med et blik på fremtiden tilføjede van der Laan, at de "er håb om, at vores arbejde vil føre til andre vigtige udviklinger, som igen vil forbedre vores forståelse af lidelser, der opstår som følge af mitokondriel dysfunktion." + Udforsk yderligere
Mitokondrier tilpasser sig effektivt til skiftende metaboliske forhold
Sidste artikelSpejlbilledmolekyler afslører tørkestress i skove
Næste artikelUndersøgelse udvikler en ny måde at identificere kræftceller på
 Varme artikler
Varme artikler
-
 Retsmedicinsk professor udforsker ny teknologi til at forbedre DNA-detektionForensics kandidatstuderende Amber Vandepoele (forrest) og forskningsassistent professor Mike Marciano evaluerer data fra DEPArray-systemet. Kredit:Syracuse University Forskningsdirektør for Forens
Retsmedicinsk professor udforsker ny teknologi til at forbedre DNA-detektionForensics kandidatstuderende Amber Vandepoele (forrest) og forskningsassistent professor Mike Marciano evaluerer data fra DEPArray-systemet. Kredit:Syracuse University Forskningsdirektør for Forens -
 Mød Madagaskars ældste dyreslægt, en hvirvlende bille med 206 millioner år gammel oprindelseH. milloti dorsal habitus. Kredit:KU Nyhedstjeneste Der er dyrebare få arter i dag i biodiversitetens hotspot på Madagaskar, som videnskabsmænd kan spore direkte tilbage til, da alle Jordens kont
Mød Madagaskars ældste dyreslægt, en hvirvlende bille med 206 millioner år gammel oprindelseH. milloti dorsal habitus. Kredit:KU Nyhedstjeneste Der er dyrebare få arter i dag i biodiversitetens hotspot på Madagaskar, som videnskabsmænd kan spore direkte tilbage til, da alle Jordens kont -
 Nordlig eksponering:fossiler af en sydlig hval fundet for første gang i nordDen mindste bardehval, Caperea marginata, sammenlignet med den største:blåhvalen, Balaenoptera musculus. Kredit:Carl Buell Gamle fossiler af en hvalarter, der menes kun at findes i sydlige farvand
Nordlig eksponering:fossiler af en sydlig hval fundet for første gang i nordDen mindste bardehval, Caperea marginata, sammenlignet med den største:blåhvalen, Balaenoptera musculus. Kredit:Carl Buell Gamle fossiler af en hvalarter, der menes kun at findes i sydlige farvand -
 Undersøgelse analyserer den ejendommelige kraniale anatomi af brøleaberKredit:Fiorenza og Bruner (2017) Emiliano Bruner, fra Paleoneurobiology Group af Centro Nacional de Investigación sobre la Evolución Humana (CENIEH), har netop offentliggjort en artikel i America
Undersøgelse analyserer den ejendommelige kraniale anatomi af brøleaberKredit:Fiorenza og Bruner (2017) Emiliano Bruner, fra Paleoneurobiology Group af Centro Nacional de Investigación sobre la Evolución Humana (CENIEH), har netop offentliggjort en artikel i America
- Hvordan er guldmined i Australien?
- Hvorfor den solide syd for midten af århundredets amerikanske politik ikke var så solid
- Hvad spiser Boxelder Bugs?
- Hjælper kundeloyalitetsprogrammer virkelig sælgere med at tjene penge?
- Den britiske regulator forbyder Ryanairs vildledende grønne reklamer
- Ultrahurtig ladningsoverførsel i preussisk blå analoger


