Sp1's dobbeltliv:Et proteins nye rolle sætter skub i at tænke på dets indvirkning på kræft
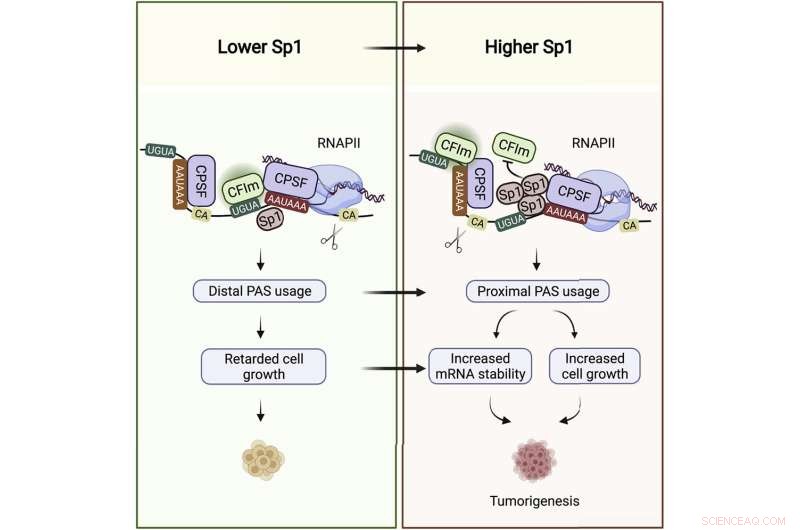
Grafisk abstrakt. Kredit:Molecular Cell (2022). DOI:10.1016/j.molcel.2022.06.031
I fire årtier er Specificity Protein 1 (Sp1) udelukkende blevet støbt som en transkriptionsfaktor, en type protein, der binder DNA og tænder gener. Men et Donnelly Center-studie har nu afsløret, at Sp1 spiller en anden uventet rolle i genregulering ved at påvirke stabiliteten af genernes RNA-meddelelser.
Fundet er især vigtigt for kræftforskningen, da det hæver den etablerede tankegang om, hvordan Sp1 bidrager til sygdommen og åbner nye veje for behandlingsudvikling.
"Sp1 har været kendt for at være involveret i kræft i lang tid, men det blev antaget at være på grund af dets evne til at binde DNA og fungere som en transkriptionsfaktor, fordi alle vidste om det," sagde Jack Greenblatt, seniorforfatter på papir og professor i molekylær genetik i Donnelly Center for Cellular and Biomolecular Research, ved U of T's Temerty Faculty of Medicine.
"Vi mener, at det ikke er svaret. Vi tror, det påvirker kræft gennem dens evne til at binde RNA og regulere transkriptionsstabiliteten," sagde Greenblatt, som også er universitetsprofessor.
Tidsskriftet Molecular Cell offentliggjort resultaterne.
Forskningen kaster uventet nyt lys over et af de mest undersøgte menneskelige proteiner. Sp1 blev først identificeret som en DNA-bindende transkriptionel aktivator for næsten 40 år siden og var den første humane transkriptionelle regulator, der blev oprenset, sagde Greenblatt. "Det er et standardemne i bachelor-lærebøger," tilføjede han.
Sp1 kontrollerer aktivering af omkring 6.000 gener - omkring en tredjedel af det menneskelige genom - som for det meste er nødvendige for cellulær næring.
Og nu er der også den RNA-bindende Sp1, som har indflydelse over en anden og for det meste ikke-overlappende gruppe på 2.000 gener ved at påvirke mængden af deres mRNA-kopier, ifølge undersøgelsen.
Når et gen tændes, bliver dets kode kopieret ind i et messenger-RNA eller et transkript, som tjener som skabelon til opbygning af det kodede proteinmolekyle. I sin ende ende rummer mRNA den utranslaterede region eller UTR, som ikke bliver oversat til protein, men som har en regulerende rolle og er vigtig for transkriptets stabilitet. Forskning har vist, at transkripter med lange UTR-haler ofte er mindre stabile og nedbrydes hurtigere af cellulære enzymer, mens korthalede UTR'er er mere beskyttet mod nedbrydning.
"Det er her, i UTR, at Sp1 binder sine mål-mRNA'er," sagde Syed Nabeel-Shah, en Ph.D. kandidat i laboratoriet og forskningens co-første forfatter sammen med tidligere Greenblatt laboratorie post-doc stipendiat, Jingwen Song. Da Nabeel-Shah og Song udtømte Sp1 fra celler, fandt de ud af, at dette førte til en stigning i visse transkripters UTR-længde, hvilket indikerer, at Sp1 virker til at give kortere UTR-haler. De viste yderligere, at UTR-trimning udføres af RNA-spaltningsmaskineriet, som klipper RNA'et tæt på, hvor Sp1 er bundet.
Kontrol af UTR-længde er dukket op som et vigtigt lag af genregulering. Dette gælder især i kræftceller, som bugner af korthalede transskriptioner. Jo kortere UTR-halen er, jo mere stabil er mRNA'et for mange transkriptioner, hvilket betyder flere proteinskabeloner – og i sidste ende flere proteinmolekyler, der kan produceres.
"Hurtigt voksende celler har brug for visse gener udtrykt på højere niveauer," sagde Greenblatt. "Effekten af at have kortere UTR'er er ofte en højere koncentration af mRNA og følgelig højere proteinkoncentration."
Det forblev dog uklart, hvordan balancen er skæv mod kortere UTR'er i kræftceller. Men Greenblatt og Nabeel-Shah mener, at Sp1 har en del af nøglen.
Det har længe været kendt, at Sp1-niveauer er forhøjede på tværs af mange typer kræft, herunder brystkræft, som Nabeel-Shah og Song fokuserede deres analyse på. De opnåede RNA-sekventeringsdata fra Cancer Genome Atlas på tusinde brystkræftpatienter. De fandt ud af, at Sp1-niveauer korrelerer med dens måltransskriptionshalelængde og -overflod. Jo mere Sp1 i en patientprøve, jo kortere er UTR'erne i den samme prøve, og jo højere er mRNA-niveauerne, når disse UTR'er er bundet af Sp1. "Alt dette tyder på, at Sp1 fremmer kræft gennem sin RNA-bindende rolle," sagde Nabeel-Shah.
Fundet er i modsætning til den etablerede opfattelse, hvor Sp1 bidrager til kræft ved at turbolade ekspressionen af dets målgener som et DNA-bindende protein. Nabeel-Shah og Song fandt ingen støtte i dataene for dette koncept. Der var ingen signifikant korrelation mellem Sp1-niveauer i brystkræftceller og mængden af mRNA transskriberet fra generne, det målretter mod på DNA.
Selvom de kun så på brystkræft, mener forskerne, at Sp1 spiller en lignende rolle i andre former for kræft, givet det store antal mRNA'er, det regulerer.
Undersøgelsen åbner op for en ny måde at tænke på ikke kun om Sp1 og dets rolle i kræftsygdommen, men også om andre lignende proteiner. Sp1 tilhører en familie af C2H2 zinkfinger transkriptionsfaktorer, som udgør den største gruppe af transkriptionsfaktorer hos mennesker. Størstedelen af dets over 700 medlemmer er dog stadig dårligt udforsket.
Målet med Nabeel-Shahs speciale er at afgøre, om en masse andre C2H2-proteiner også binder RNA. Indtil videre har han testet 150 af disse proteiner og fundet ud af, at 145 binder både DNA og RNA, hvilket tyder på, at mange andre medlemmer også kan have dobbeltroller i genregulering.
Sp1 var kun den første, der blev opdaget, ligesom for fire årtier siden. + Udforsk yderligere
Genekspressionsmekanisme kan have immunitet, kræftimplikationer
 Varme artikler
Varme artikler
-
 Embryoblodceller er stamcelle-uafhængige(Venstre) I standardmodellen genereres hæmatopoietiske progenitorer fra HSCer. (Til højre) I den foreslåede model genereres HSCer og progenitorer uafhængigt af præ-hæmatopoietiske stam- og progenitorc
Embryoblodceller er stamcelle-uafhængige(Venstre) I standardmodellen genereres hæmatopoietiske progenitorer fra HSCer. (Til højre) I den foreslåede model genereres HSCer og progenitorer uafhængigt af præ-hæmatopoietiske stam- og progenitorc -
 Sikkerhed, ikke mad, lokker gæs til byerNy forskning viser, at sikkerhed fra jægere, snarere end rigelig mad, er det, der trækker canadagæs til byer som Chicago. Kredit:M. Horath Canadagæs har flyttet deres vinterområde nordpå i de sene
Sikkerhed, ikke mad, lokker gæs til byerNy forskning viser, at sikkerhed fra jægere, snarere end rigelig mad, er det, der trækker canadagæs til byer som Chicago. Kredit:M. Horath Canadagæs har flyttet deres vinterområde nordpå i de sene -
 Udviklingen i din baghave – stormejser tilpasser muligvis deres næb til fuglefoderStormejse (Parus major) på en havefoderautomat. Kredit:Dennis van de Water, dvdwphotography.com En britisk entusiasme for at fodre fugle kan have forårsaget, at britiske stormejser har udviklet læ
Udviklingen i din baghave – stormejser tilpasser muligvis deres næb til fuglefoderStormejse (Parus major) på en havefoderautomat. Kredit:Dennis van de Water, dvdwphotography.com En britisk entusiasme for at fodre fugle kan have forårsaget, at britiske stormejser har udviklet læ -
 Udryddelse truer for to sjældne fuglearter efter ødelæggende orkanerKredit:Florida International University Bevaringsbiolog Paul Reillo er revet mellem to verdener i kølvandet på orkanerne Irma og Maria - en af hurtig handling og en af ventetid. Der er lidt t
Udryddelse truer for to sjældne fuglearter efter ødelæggende orkanerKredit:Florida International University Bevaringsbiolog Paul Reillo er revet mellem to verdener i kølvandet på orkanerne Irma og Maria - en af hurtig handling og en af ventetid. Der er lidt t
- Hvordan er kræft og bevægelsesrelateret?
- Facebook ud over Facebook? Instagram, Messenger rykker op
- Ny kilde til global nitrogen opdaget
- Giftig smog kapper New Delhi morgen efter Diwali-festligheder
- Rumskrot – undgå katastrofe med Falcon Telescope Network
- Forskere præsenterer en ny tilgang til overvågning af ferskvands sundhed


