Hvordan en jordmikrobe kunne sætte gang i kunstig fotosyntese
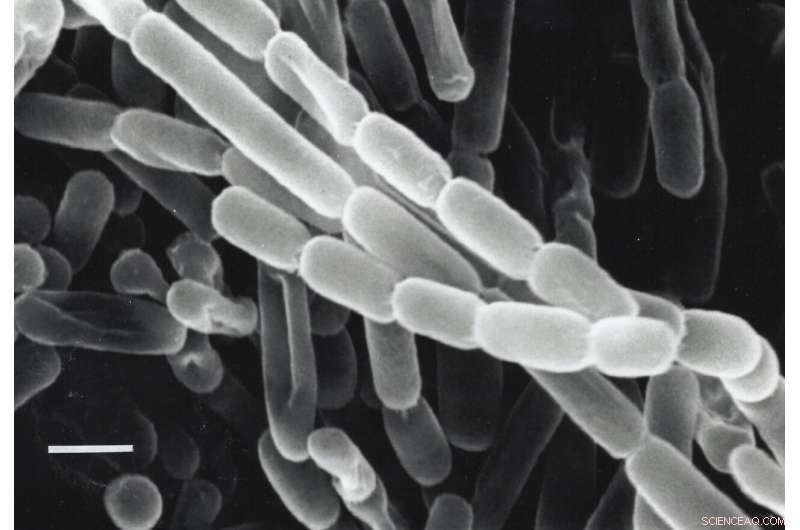
Et nærbillede af Kitasatospora setae, en bakterie isoleret fra jord i Japan. Disse bakterier fikserer kulstof - forvandler kuldioxid fra deres miljø til biomolekyler, de har brug for for at overleve - takket være enzymer kaldet ECR'er. Forskere leder efter måder at udnytte og forbedre ECR'er til kunstig fotosyntese for at producere brændstoffer, antibiotika og andre produkter. Kredit:Y. Takahashi &Y. Iwai
Planter er afhængige af en proces kaldet kulstoffiksering - forvandling af kuldioxid fra luften til kulstofrige biomolekyler - for selve deres eksistens. Det er hele pointen med fotosyntese og en hjørnesten i det enorme sammenlåsende system, der kredser kulstof gennem planter, dyr, mikrober og atmosfæren for at opretholde livet på Jorden.
Men kulstoffikseringsmesterne er ikke planter, men jordbakterier. Nogle bakterielle enzymer udfører et nøgletrin i kulstoffiksering 20 gange hurtigere end planteenzymer gør, og at finde ud af, hvordan de gør dette, kan hjælpe videnskabsmænd med at udvikle former for kunstig fotosyntese til at omdanne drivhusgassen til brændstoffer, gødning, antibiotika og andre produkter.
Nu har et team af forskere fra Department of Energy's SLAC National Accelerator Laboratory, Stanford University, Max Planck Institute for Terrestrial Microbiology i Tyskland, DOE's Joint Genome Institute (JGI) og University of Concepción i Chile opdaget, hvordan et bakterielt enzym - et molekylært maskine, der letter kemiske reaktioner – skruer op for at udføre denne bedrift.
I stedet for at gribe kuldioxidmolekyler og fastgøre dem til biomolekyler et ad gangen, fandt de ud af, at dette enzym består af par af molekyler, der arbejder synkront, som hænderne på en jonglør, der samtidig kaster og fanger bolde, for at få arbejdet gjort hurtigere . Et medlem af hvert enzympar åbner sig vidt for at fange et sæt reaktionsingredienser, mens det andet lukker sig over dets indfangede ingredienser og udfører den carbonfikserende reaktion; derefter skifter de roller i en kontinuerlig cyklus.
En enkelt plet af molekylær "lim" holder hvert par enzymatiske hænder sammen, så de kan skiftevis åbne og lukke på en koordineret måde, opdagede holdet, mens en vridende bevægelse hjælper med at presse ingredienser og færdige produkter ind og ud af lommerne, hvor reaktionerne finde sted. Når både lim og twist er til stede, går den carbonfikserende reaktion 100 gange hurtigere end uden dem.
"Dette bakterielle enzym er det mest effektive kulstoffikseringsmiddel, som vi kender til, og vi kom med en pæn forklaring på, hvad det kan gøre," sagde Soichi Wakatsuki, professor ved SLAC og Stanford og en af de øverste ledere af undersøgelsen. som blev offentliggjort i ACS Central Science denne uge.
"Nogle af enzymerne i denne familie virker langsomt, men på en meget specifik måde for at producere kun ét produkt," sagde han. "Andre er meget hurtigere og kan fremstille kemiske byggesten til alle mulige produkter. Nu hvor vi kender mekanismen, kan vi konstruere enzymer, der kombinerer de bedste egenskaber ved begge tilgange og gør et meget hurtigt stykke arbejde med alle mulige udgangsmaterialer."
Forbedring af naturen
Enzymet, som holdet undersøgte, er en del af en familie kaldet enoyl-CoA-carboxylaser/reduktaser eller ECR'er. Det kommer fra jordbakterier kaldet Kitasatospora setae, som udover deres kulstoffikserende evner også kan producere antibiotika.
Wakatsuki hørte om denne enzymfamilie for et halvt dusin år siden fra Tobias Erb fra Max Planck Institute for Terrestrial Microbiology i Tyskland og Yasuo Yoshikuni fra JGI. Erbs forskerhold havde arbejdet på at udvikle bioreaktorer til kunstig fotosyntese for at omdanne kuldioxid (CO2 ) fra atmosfæren til alle mulige produkter.
Lige så vigtig som fotosyntese er for livet på Jorden, sagde Erb, er den ikke særlig effektiv. Som alle ting, der er formet af eonernes udvikling, er det kun så godt, som det behøver at være, resultatet af langsomt at bygge videre på tidligere udviklinger, men aldrig opfinde noget helt nyt fra bunden.
Hvad mere er, sagde han, skridtet i naturlig fotosyntese, der fikserer CO2 fra luften, som er afhængig af et enzym kaldet Rubisco, er en flaskehals, der bunder hele kæden af fotosyntetiske reaktioner ned. Så brug af hurtige ECR-enzymer til at udføre dette trin og konstruktion af dem til at gå endnu hurtigere, kunne bringe et stort løft i effektiviteten.
"Vi forsøger ikke at lave en carbonkopi af fotosyntese," forklarede Erb. "Vi ønsker at designe en proces, der er meget mere effektiv ved at bruge vores forståelse af teknik til at genopbygge naturbegreberne. Denne 'fotosyntese 2.0' kunne finde sted i levende eller syntetiske systemer såsom kunstige kloroplaster - dråber af vand suspenderet i olie."
Portrætter af et enzym
Wakatsuki og hans gruppe havde undersøgt et relateret system, nitrogenfiksering, som omdanner nitrogengas fra atmosfæren til forbindelser, som levende ting har brug for. Han var fascineret af spørgsmålet om, hvorfor ECR-enzymer var så hurtige, og begyndte at samarbejde med Erbs gruppe for at finde svar.
Hasan DeMirci, en forskningsmedarbejder i Wakatsukis gruppe, som nu er adjunkt ved Koc University og efterforsker ved Stanford PULSE Institute, ledede indsatsen hos SLAC med hjælp fra et halvt dusin SLAC sommer praktikanter, han overvågede. "Vi træner seks eller syv af dem hvert år, og de var frygtløse," sagde han. "De kom med åbent sind, klar til at lære, og de gjorde fantastiske ting."
SLAC-teamet lavede prøver af ECR-enzymet og krystalliserede dem til undersøgelse med røntgenstråler ved Advanced Photon Source på DOE's Argonne National Laboratory. Røntgenstrålerne afslørede enzymets molekylære struktur - arrangementet af dets atomare stilladser - både alene og når det er knyttet til et lille hjælpemolekyle, der letter dets arbejde.
Yderligere røntgenundersøgelser ved SLAC's Stanford Synchrotron Radiation Lightsource (SSRL) viste, hvordan enzymets struktur ændrede sig, når det fæstnet til et substrat, en slags molekylært arbejdsbord, der samler ingredienser til carbonfikseringsreaktionen og ansporer reaktionen.
Endelig udførte et team af forskere fra SLAC's Linac Coherent Light Source (LCLS) mere detaljerede undersøgelser af enzymet og dets substrat ved Japans SACLA X-ray free-electron laser. Valget af en røntgenlaser var vigtigt, fordi det gav dem mulighed for at studere enzymets adfærd ved stuetemperatur – tættere på dets naturlige miljø – næsten uden strålingsskader.
I mellemtiden udførte Erbs gruppe i Tyskland og lektor Esteban Vöhringer-Martinez' gruppe ved University of Concepción i Chile detaljerede biokemiske undersøgelser og omfattende dynamiske simuleringer for at give mening i de strukturelle data indsamlet af Wakatsuki og hans team.

Denne afbildning af ECR, et enzym, der findes i jordbakterier, viser hvert af dets fire identiske molekyler i en anden farve. Disse molekyler arbejder sammen i par - blå med hvid og grøn med orange - for at omdanne kuldioxid fra mikrobens miljø til biomolekyler, den har brug for for at overleve. En ny undersøgelse viser, at en plet af molekylær lim og et rettidigt sving og drejning giver disse par mulighed for at synkronisere deres bevægelser og fiksere kulstof 20 gange hurtigere end planteenzymer gør under fotosyntesen. Kredit:H. DeMirci et al.
Simuleringerne afslørede, at åbningen og lukningen af enzymets to dele ikke kun involverer molekylær lim, men også vridningsbevægelser omkring den centrale akse af hvert enzympar, sagde Wakatsuki.
"Dette twist er næsten som en rachet, der kan skubbe et færdigt produkt ud eller trække et nyt sæt ingredienser ned i lommen, hvor reaktionen finder sted," sagde han. Sammen giver drejningen og synkroniseringen af enzymparrene dem mulighed for at fiksere kulstof 100 gange i sekundet.
ECR-enzymfamilien omfatter også en mere alsidig gren, der kan interagere med mange forskellige slags biomolekyler for at producere en række produkter. Men da de ikke holdes sammen af molekylær lim, kan de ikke koordinere deres bevægelser og fungerer derfor meget langsommere.
"Hvis vi kan øge hastigheden af disse sofistikerede reaktioner for at lave nye biomolekyler," sagde Wakatsuki, "ville det være et betydeligt spring i feltet."
Fra statiske optagelser til flydende film
Indtil videre har eksperimenterne produceret statiske øjebliksbilleder af enzymet, reaktionsingredienserne og slutprodukterne i forskellige konfigurationer.
"Vores drømmeeksperiment," sagde Wakatsuki, "ville være at kombinere alle ingredienserne, når de strømmer ind i røntgenlaserstrålens vej, så vi kunne se reaktionen finde sted i realtid."
Holdet prøvede faktisk det på SACLA, sagde han, men det virkede ikke. "CO2 molekyler er virkelig små, og de bevæger sig så hurtigt, at det er svært at fange det øjeblik, hvor de hæfter sig til substratet," sagde han. "Pluds er røntgenlaserstrålen så stærk, at vi ikke kunne holde ingredienserne i den længe. nok til at reaktionen kan finde sted. Da vi pressede hårdt på for at gøre dette, lykkedes det os at bryde krystallerne."
En kommende højenergiopgradering til LCLS vil sandsynligvis løse dette problem, tilføjede han, med impulser, der kommer meget hyppigere - en million gange i sekundet - og kan justeres individuelt til den ideelle styrke for hver prøve.
Wakatsuki sagde, at hans team fortsætter med at samarbejde med Erbs gruppe, og det arbejder med LCLS prøveleveringsgruppen og med forskere ved SLAC-Stanfords kryogene elektronmikroskopi (cryo-EM) faciliteter for at finde en måde at få denne tilgang til at fungere.
 Varme artikler
Varme artikler
-
 Betragtes som økologisk uddøde i naturen, Den burmesiske stjerneskildpaddebestand er vokset til me…Den burmesiske stjerneskildpadde ( Geochelone platynota ), en mellemstor skildpadde, der kun findes i Myanmars centrale tørre zone, er blevet bragt tilbage fra randen af udryddelse takket være en
Betragtes som økologisk uddøde i naturen, Den burmesiske stjerneskildpaddebestand er vokset til me…Den burmesiske stjerneskildpadde ( Geochelone platynota ), en mellemstor skildpadde, der kun findes i Myanmars centrale tørre zone, er blevet bragt tilbage fra randen af udryddelse takket være en -
 Hvad er de fire makromolekyler i livet?Biologi - eller uformelt, selve livet - er kendetegnet ved elegante makromolekyler, der har udviklet sig over hundreder af millioner af år til at tjene en række kritiske funktioner. Disse er ofte kate
Hvad er de fire makromolekyler i livet?Biologi - eller uformelt, selve livet - er kendetegnet ved elegante makromolekyler, der har udviklet sig over hundreder af millioner af år til at tjene en række kritiske funktioner. Disse er ofte kate -
 Projekt for at give offentlig adgang til højopløselige 3D-modeller af hvirveldyrs anatomioVert-projektet vil gøre det muligt at generere 3-D-modeller til uddannelse og outreach. Kredit:University of Kansas En ny indsats blandt 16 forskningsinstitutioner vil skabe høj opløsning, digita
Projekt for at give offentlig adgang til højopløselige 3D-modeller af hvirveldyrs anatomioVert-projektet vil gøre det muligt at generere 3-D-modeller til uddannelse og outreach. Kredit:University of Kansas En ny indsats blandt 16 forskningsinstitutioner vil skabe høj opløsning, digita -
 Bekymringsvinde:Amerikanske fiskere frygter skove af kraftturbinerI denne mandag, 15. august, 2016, fil foto tre vindmøller fra Deepwater Wind-projektet står i Atlanterhavet ud for Block Island, R.I. Fishermen vender et forsigtigt øje mod en ny opkomling:havvindindu
Bekymringsvinde:Amerikanske fiskere frygter skove af kraftturbinerI denne mandag, 15. august, 2016, fil foto tre vindmøller fra Deepwater Wind-projektet står i Atlanterhavet ud for Block Island, R.I. Fishermen vender et forsigtigt øje mod en ny opkomling:havvindindu
- Maskinlæring i aktion for den humanitære sektor
- At arbejde hjemmefra gør os ikke mindre produktive
- Ny undersøgelse beskriver, hvordan overfladestruktur kan hjælpe eller forhindre dannelse af iskrys…
- Hvorfor bliver Avocados røde?
- Hvad er de generelle karakteristika for Monerans?
- Emissioner af fossilt brændstof ramte rekordhøjt efter uventet vækst—Global Carbon Budget 2017


