Hvordan bakterier undslipper bakteriofager in vivo
Grafisk abstrakt. Kredit:Cell Host &Microbe (2022). DOI:10.1016/j.chom.2022.03.014
Fagterapi, som bruger vira kendt som bakteriofager til at behandle bakterielle infektioner, er en langvarig medicinsk procedure, hvis virkningsmekanismer stadig er dårligt forstået. Forskere fra Institut Pasteur og CNRS har vist in vivo i en murin model, at bakterier er i stand til at regulere deres genekspression for at undgå de talrige bakteriofager, der er til stede i tarmmiljøet. Denne forskning forklarer forskellen i bakteriofageffektivitet mellem in vitro og in vivo tilstande. Resultaterne blev offentliggjort i tidsskriftet Cell Host &Microbe den 13. april 2022.
Fagterapi er en medicinsk tilgang, der involverer behandling af bakterielle infektionssygdomme ved hjælp af den naturlige evne hos visse vira, kendt som bakteriofager, til at dræbe bakterier, som de specifikt genkender. Et betydeligt fald i brugen af denne terapeutiske strategi opdaget for over 100 år siden blev set i Vesten efter udviklingen af antibiotika. Men stillet over for en alarmerende stigning i antallet af infektioner forårsaget af antibiotika-resistente bakterier og den bekymrende udsigt til at stå uden behandlingsmuligheder, søger videnskabsmænd at kaste lys over bakteriofagers virkningsmekanisme.
Bakterier og bakteriofager er de mest udbredte enheder i den menneskelige tarmmikrobiota. Selvom bakteriofager dræber bakterier, eksisterer de to antagonistpopulationer sammen i en balance i tarmen.
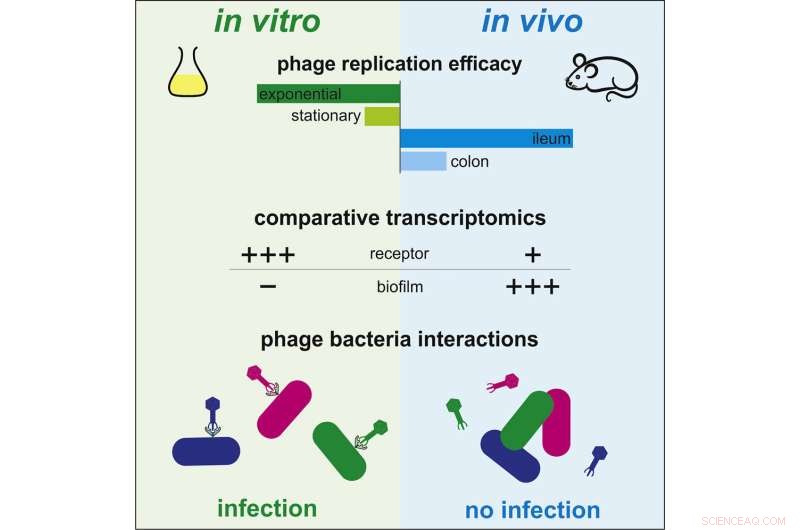
Indtil nu har der ikke været tilstrækkelige videnskabelige data til rådighed til at forstå, hvordan fagterapi virker in vivo. Interaktioner mellem bakterier og bakteriofager er derimod blevet grundigt undersøgt in vitro. Under disse forhold inficerer bakteriofager hurtigt bakterier, replikerer og ødelægger bakterier, mens de frigiver nye vira, der er i stand til at inficere andre bakterier. Imidlertid er dynamikken observeret mellem disse to mikroorganismer meget forskellig i tarmen hos pattedyr. Nogle bakteriofager, der er effektive i dyrkningsmediet, er totalt ineffektive i tarmmiljøet.
For at forstå denne forskel besluttede forskere ved Institut Pasteur og CNRS at sammenligne genekspressionsprofilen, eller transkriptomet, af bakterien Escherichia coli i begge sammenhænge:kulturmedier og tarmen. Ved hjælp af denne metode afslørede de genetiske reguleringer, der karakteriserer bakteriens tilpasning til tarmmiljøet.
Ved nøje at undersøge generne involveret i denne tilpasning afslørede de fire gener, der modulerer bakteriens modtagelighed over for bakteriofager. "Vi observerede, at visse gener, der kræves til infektion med bakteriofager, udtrykkes mindre i tarmen end in vitro, og dermed beskytter bakterier mod bakteriofager," kommenterede Laurent Debarbieux, leder af Bacteriophage, Bacterium, værtsenhed ved Institut Pasteur (CNRS fælles enhed) og sidste forfatter til undersøgelsen. Forskerne var i stand til at verificere deres teori ved at eliminere ekspressionen af et bestemt gen. De observerede, at bakteriel modtagelighed for en bakteriofag var signifikant reduceret. Som følge heraf er bakterier i tarmen i stand til at modstå prædation fra bakteriofager ved at modulere ekspressionen af visse gener i stedet for at mutere deres genom.
Denne undersøgelse viser derfor, at miljø spiller en fremherskende rolle i interaktioner mellem bakterier og bakteriofager. Disse resultater baner vejen for forbedret brug af bakteriofager til terapeutiske formål.
 Varme artikler
Varme artikler
-
 Afdækning af en vendbar hovedkontakt til udviklingKredit:CC0 Public Domain I et papir udgivet i Gener og udvikling , BWHs hovedforsker Mitzi Kuroda, Ph.d., og hendes team identificerede en reversibel master switch på de fleste udviklingsgener.
Afdækning af en vendbar hovedkontakt til udviklingKredit:CC0 Public Domain I et papir udgivet i Gener og udvikling , BWHs hovedforsker Mitzi Kuroda, Ph.d., og hendes team identificerede en reversibel master switch på de fleste udviklingsgener. -
 Lever den buff-breasted knap-vagtel stadig? Dette århundrede gamle fuglemysterium mangler endnu at …Den eneste australske fugleart, som forbliver ufotograferet. Dette er en af de mest nøjagtige illustrationer af arten. Kredit:John Keulemans, offentliggjort i Gregory Mathews The Birds of Australia
Lever den buff-breasted knap-vagtel stadig? Dette århundrede gamle fuglemysterium mangler endnu at …Den eneste australske fugleart, som forbliver ufotograferet. Dette er en af de mest nøjagtige illustrationer af arten. Kredit:John Keulemans, offentliggjort i Gregory Mathews The Birds of Australia -
 Hvad er den værste udryddelse i Jordens historie?Selvom det er betydningsfuldt, masseudryddelsen, der dræbte dinosaurerne, er ikke den største i historien. Her, paleontologer graver resterne af en fjern fortid op. © Didier Dutheil/Sygma/Corbis Udry
Hvad er den værste udryddelse i Jordens historie?Selvom det er betydningsfuldt, masseudryddelsen, der dræbte dinosaurerne, er ikke den største i historien. Her, paleontologer graver resterne af en fjern fortid op. © Didier Dutheil/Sygma/Corbis Udry -
 Forskere sætter probiotika i mad og kosttilskud på prøveSandra Buerger og hendes studerende Alexander Smith studerer den bakterielle sammensætning af probiotika. Kredit:Boston University Det er et godt tidspunkt at være en bakterie. I mere end et århu
Forskere sætter probiotika i mad og kosttilskud på prøveSandra Buerger og hendes studerende Alexander Smith studerer den bakterielle sammensætning af probiotika. Kredit:Boston University Det er et godt tidspunkt at være en bakterie. I mere end et århu
- Solar car startup Sono skal bygge i Sverige, starter i 2020
- Hvordan man holder fugle væk fra Patio
- Xiaomi søger at rejse op til $6 milliarder i Hong Kong IPO
- Madvaner for malaysiske frugtflagermus
- Earths 2017 ressourcebudget brugt pr. 2. august:rapport
- Hvad er funktionerne ved stivelse i planteceller?


