Hvordan bakterier selvvaccinerer mod virale angribere

Når vira introduceres til en plade, der er tilgroet med S. aureus (beige), begynder de at dræbe bakterierne og producere døde områder, hvor ingen bakterier kan vokse (grå). Kredit:Rockefeller University
Ligesom de fleste organismer, er bakterier byttet ud af vira - og deres go-to-tilgang til at ødelægge angriberne er simpelthen at hugge dem op. Så snart den ser en virus, kan en bakterie anvende et væld af immunstrategier til at skære sit genom op ved hjælp af molekylære cutters såsom CRISPR-Cas, også navnebror af et populært laboratorieværktøj.
En ny undersøgelse viser nu, at bakteriers forsvarsstrategier ikke fungerer isoleret. Forskere ved The Rockefeller University opdagede, at et overraskende niveau af samarbejde finder sted mellem CRISPR-Cas-systemet og bakteriers anden fremtrædende forsvarsstrategi, kendt som restriktionsenzymer. "Mange forskere har brugt et eller begge af disse systemer til deres forskning, men vi vidste ikke, i hvilket omfang de er forbundet i bakterier," siger Luciano Marraffini, Kayden Family Professor ved Rockefeller og en efterforsker ved Howard Hughes Medical Institute .
Resultaterne, offentliggjort i Molecular Cell , viser, at mens restriktionsenzymer fungerer som den første forsvarslinje, forbereder de også det materiale, som CRISPR-Cas skal bruge for at målrette viruset med præcision. "Mekanismen minder om vores egen flerstrengede immunrespons," siger Marraffini. "Det inkluderer en midlertidig første forsvarslinje, før den aktiverer et andet, mere robust adaptivt svar."
Multi-trins beskyttelse
Restriktionsenzymer er i stand til at spalte korte DNA-sekvenser, så bakterien gør brug af dem, lige så snart virussen invaderer bakteriecellen. CRISPR-Cas, et mere sofistikeret system, kommer senere. Mens restriktionsenzymet hakker virus-DNA op med en plæneklippers råhed, er CRISPR-Cas som en knivskarp saks, der bruges af en omhyggelig gartner. Den skærer den virale ubudne gæst i stykker med ulastelig præcision ved pænt at justere den til en molekylær guide, der er målrettet mod en specifik genetisk sekvens.
Begge typer bakterieforsvar bruges almindeligvis af biologer, hvis daglige gøremål involverer manipulation af DNA til forskellige formål - som at sekventere gener, få molekyler til at fluorescere eller skabe dyr med modificerede genomer. I 1970'erne brugte videnskabsmænd restriktionsenzymer til at udvikle et nyt værktøj kaldet rekombinant DNA, som gjorde det muligt at klone og studere enkelte gener. Og for et årti siden revolutionerede teknologi baseret på CRISPR-Cas biovidenskaben ved at give videnskabsfolk mulighed for at redigere genomer i levende celler og organismer.
Ved at arbejde med Staphylococcus aureus fandt Pascal Maguin, en kandidat i Marraffinis laboratorium ud af, at denne bakteries virushakningsstrategier fungerer bedre sammen end alene. Når Staph kun er beskyttet af restriktionsenzymer, er deres forsvar kortvarigt, fordi nogle af vira til sidst vil begynde at beskytte deres DNA - og efter et stykke tid, viser deres undersøgelse, vil bakterierne, der vokser i skålen, begynde at svinde ind. Hvis Staph har adgang til begge systemer, genoprettes de dog hurtigt.
Maguin og hans kolleger fandt ud af, hvordan de to systemer fungerer sammen - segmenter, der tidligere er klippet af restriktionsenzymer, hjælper CRISPR-Cas-maskineriet med at generere den molekylære guide, der er nødvendig for at finde vira og sætte en stopper for infektionen.
"Det er lidt ligesom vaccination," siger Marraffini. "Restriktionsenzymet skærer små stykker af virussen, som CRISPR derefter vil bruge til at igangsætte en adaptiv reaktion."
Resultaterne kan ikke kun hjælpe os med at forstå, hvordan Staph forsvarer sig mod vira; der er en chance for, at de også kan gøre os bedre rustet til at forsvare os mod Staph – en art, der er berygtet for sin evne til at blive resistente over for antibiotika. Sidste år fandt Marraffinis team ud af, at bakterien bruger sit CRISPR-Cas-system ikke kun til at afværge vira, men også til at udvikle resistens mod flere lægemidler. En bedre forståelse af systemet kunne en dag give videnskabsmænd mulighed for at manipulere det med lægemidler for at bekæmpe Staph-infektioner, der ikke reagerer på andre behandlinger.
Sidste artikelKan insekter blive fede?
Næste artikelHvordan boaer redder sig selv fra at blive kvalt, når de snerper og fordøjer aftensmad
 Varme artikler
Varme artikler
-
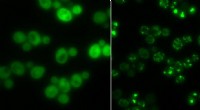 Klumper som midlertidig opbevaringGærceller uden proteinaggregater (til venstre) og dem med (lyse lysende pletter):I tider med sult, Klumperne tjener som midlertidig opbevaring for proteiner. Kredit:Matthias Peter / ETH Zürich For
Klumper som midlertidig opbevaringGærceller uden proteinaggregater (til venstre) og dem med (lyse lysende pletter):I tider med sult, Klumperne tjener som midlertidig opbevaring for proteiner. Kredit:Matthias Peter / ETH Zürich For -
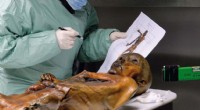 Otzi ismanden spiste et fedtfattigt sidste måltidForskere studerer de mumificerede rester af Otzi, de 5, 300-årig mand, hvis frosne lig blev fundet i de italienske alper i 1991. Sydtyrolsmuseet for arkæologi/EURAC/Samadelli/Staschitz Disse dage, ma
Otzi ismanden spiste et fedtfattigt sidste måltidForskere studerer de mumificerede rester af Otzi, de 5, 300-årig mand, hvis frosne lig blev fundet i de italienske alper i 1991. Sydtyrolsmuseet for arkæologi/EURAC/Samadelli/Staschitz Disse dage, ma -
 Lidt stress er godt for cellulær sundhed og lang levetidKredit:CC0 Public Domain Northwestern Universitys molekylære biovidenskabsmænd har opdaget, at lidt stress kan være godt for cellulær sundhed. Resultaterne vil hjælpe forskere med bedre at forstå
Lidt stress er godt for cellulær sundhed og lang levetidKredit:CC0 Public Domain Northwestern Universitys molekylære biovidenskabsmænd har opdaget, at lidt stress kan være godt for cellulær sundhed. Resultaterne vil hjælpe forskere med bedre at forstå -
 Hvad får durian-frugten til at stinke? Kræftforskere knækker durian-genometDurian (intakt og åben). Kredit:Kevin Lim, Yong Chern Han, Cedric Ng Singaporeanske videnskabsmænd og internationale samarbejdspartnere har opnået verdens første ved at dechifrere det komplette ge
Hvad får durian-frugten til at stinke? Kræftforskere knækker durian-genometDurian (intakt og åben). Kredit:Kevin Lim, Yong Chern Han, Cedric Ng Singaporeanske videnskabsmænd og internationale samarbejdspartnere har opnået verdens første ved at dechifrere det komplette ge
- Bredere opsving i kraftige storme kan øge chancen for at ødelægge hagl
- Giver vindommere højere karakterer til vine lavet med mindre kendte druesorter?
- Billede:Frilagt grundfjeld på Red Planets hale krater
- Fossil jagt i Idaho
- Bytræer kan opveje varmeøer i nabolaget, siger forsker
- Korrigering af et trick af lyset bringer molekyler til syne


