Når fossiler kommer til live:SARS-CoV-2-spids, syncytin-1 og andre nysgerrige fusionsproteiner
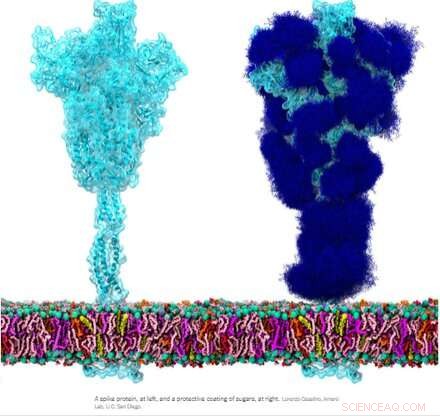
Kredit:Wikipedia
Det homotrimere spike glycoprotein (S) fra SARS-CoV-2, især dets S2-underenhed, er et ekstraordinært fusionsprotein. Det kan fusionere virale partikler til celler og også fusionere celler til celler for at skabe mangfoldige syncytier blandt forskellige cellefænotyper. Afhængigt af hvilke eksakte versioner der overvejes, kan spidsen udføre disse bedrifter via flere mekanismer, der virker på både de intracellulære og ekstracellulære sider af cellemembraner.
Disse fusionsfunktioner er noget analoge med typiske homotrimere ENV (kappe)-proteiner som vores syncytin-1 endogene retrovirale ENV-protein og GP160 ENV-glycoproteinet fra HIV-viruset. GP160, HIV-'spike'-proteinet, behandles i sidste ende på sit eget furin-spaltningssted (findes også i syncytin-1) til et GP120- og et GP41-protein, som begge kan antage forskellige præ- og postfusionskonfigurationer. SARS-CoV-2-genomet specificerer imidlertid allerede et separat lille ENV-protein (bekvemt betegnet som E), som samles til en formodet kationkanal med en central fusionspore.
Der er ingen env-, pol-, gag- eller pro-gener defineret som sådan for SARS-CoV-2-genomet, som det er tilfældet for retrovira, der skal integreres i vores DNA som en del af deres livscyklus. Mærkeligt nok har forskere fundet ud af, at SARS-CoV-2-spidsproteinet, der opfører sig af sig selv, direkte deltager i aktiveringen af endogene retrovira i vores celler, hvilket bidrager til observeret patologi. Hvad er det præcis, der foregår her?
I lyset af nogle af disse ligheder er det blevet foreslået, at antistoffer genereret mod spidsproteinet potentielt kunne krydsreagere i ethvert væv, der kunne udtrykke endogene retrovirale proteiner. Især under graviditet, hvorefter placentale trofoblaster udtrykker meget nyttige ENV-proteiner fra mange sådanne HERV'er, herunder ERVW1 (syncytin-1), ERVFRD-1 (syncytin-2), ERVV-1, ERVV-2, ERVH48-1, ERVMER34-1 ERV3-1 og ERVK13-1. Syncytin-2-ekspression i villøse cytotrofoblaster er imidlertid stærkt korreleret med sværhedsgraden af nogle placenta patologier, såsom præeklampsi.
Heldigvis fandt forskerne ud af, at der praktisk talt ikke er nogen direkte sekvenshomologi mellem spike og syncytin-1 og lille chance for krydsreaktivitet. Skrivning i tidsskriftet Animal Cells and Systems , testede koreanske forskere et stort panel af monoklonale antistoffer og var i stand til at konkludere, at mens gamle genomiske relikvier som HERV'er kan aktiveres i forskellige væv af SARS-CoV-2, er der ingen risiko for krydsreaktivitet eller endda infertilitet.
Men hvis spidsprotein stadig er meget i stand til at forårsage uønsket cellefusion, hvordan kan vi bedre definere denne tilsyneladende tilfældige aktivitet, og hvad kan vi desuden gøre ved det? Måske er det første skridt at blive lidt mere sofistikeret med terminologien for cellefusion. Skrivning i journalen Oncotarget , giver forfatteren Yuri Lazebnik lidt stof til eftertanke. Et syncytium fremstillet af celler af samme type, for eksempel som i fusionen af to eller flere pneumocytter, kaldes et homokaryon. Et heterokaryon ville da være et syncytium lavet af f.eks. en pneumocyt fusioneret til en epitelstamfader, eller måske en leukocyt. Generelt er alle væddemål slået fra, når celler først kombinerer – om de senere kan sortere sig selv og deres kerner for at generere replikationskompetente mononukleære afkom, er stadig ufuldstændigt kendt.
Dannelse af spike-inducerede syncytia i lungerne hos COVID-10-patienter er blevet fundet i mange former, hver med deres egne emergent egenskaber, der kan bidrage til sygdomsfølger. For eksempel har cilierede celler i luftvejen, alveolære type 2-pneumocytter og epitheliale progenitorer alle vist sig at deltage i de ofte observerede multinukleære 'gigantiske celler'. Smid en spidsfyldt leukocyt eller to ind, og tingene bliver hurtigt svære at forudsige. Måske en endnu mere alarmerende situation ville være dannelsen af et syncytium i cellerne, der forer vores blodkar, som kunne bidrage til trombose. Den deraf følgende død og den endelige afskæring af et plaster af uhensigtsmæssigt fusionerede celler kunne afsløre et betydeligt område af trombogen basalmembran. En 20-mikron fiber af kollagen, hovedbestanddelen af basalmembranen, er tilstrækkelig til at udløse blodpladeafhængig koagulation.
Men nok af denne frygtindgydelse. Forskere har identificeret et sæt allerede godkendte lægemidler, der forhindrer spike-induceret cellefusion og hæmmer TMEM16F, et kritisk protein for syncytiumdannelse. TMEM16F har den dobbelte rolle at være en calciumaktiveret ionkanal, der regulerer chloridsekretion, såvel som en lipid scramblase, der flytter phosphatidylserin (PS) til celleoverfladen. Denne PS-eksternisering er påkrævet til cellefusion i mange systemer, herunder spike-inducerede syncytia. I øvrigt styrer scramblaser også de hastighedsbegrænsende trin i blodkoagulationskaskaden, og kan være mekanismen bag spike-induceret trombose.
Blodkoagulationsvejene er en hel separat kompleks dåse af orme, men det er tilstrækkeligt at sige her, at den primære udløser af koagulation induceret af virusinfektioner er den såkaldte ydre 'tenase'. Tenaser er enzymer, der behandler faktor X, eller FX, (derfor ten-ase), i Tissue Factor (TF) aktiveringsvejen, som i det væsentlige fungerer som sikringen til trombedannelse. De resulterende komplekser samles på eksternaliseret PS i nærvær af calciumioner. TF er på en måde krypteret og er derfor ikke i stand til at aktivere sin downstream-målfaktor FVIIa, før den er dekrypteret af eksternaliseret PS.
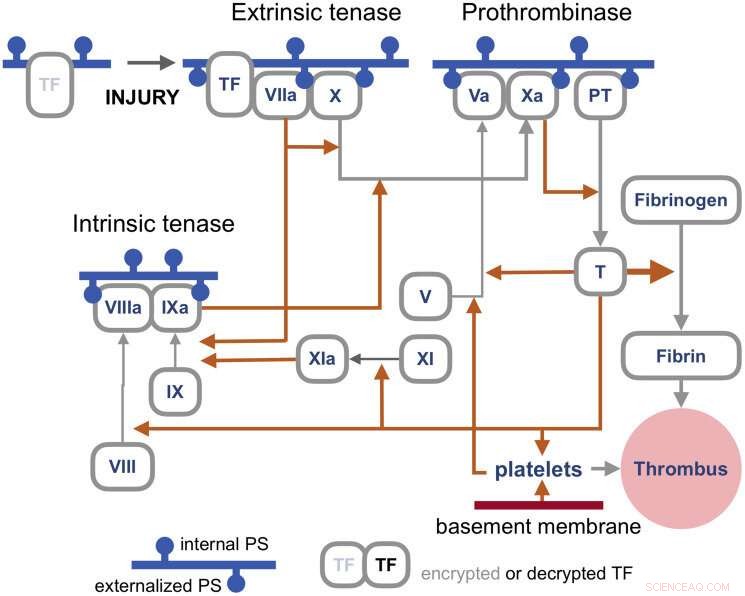
Koagulationsveje. Kredit:Y. Lazebnik 2021
Erkendelsen af, at nogle fusogene virale eller endda retrovirale proteiner, som tilfældigt udtrykkes i bestemte områder af kroppen, sandsynligvis kan bidrage til trombotiske hændelser, er af enorm praktisk betydning. Man behøver ikke lede længere end Modernas rigelige foreslåede pipeline for terapeutiske mRNA-leverede faciliteter baseret på disse proteiner, for at alle slags virale fornærmelser skal have en pause til inspektion. Der er bestemt ingen mangel på metoder, der i øjeblikket anvendes til at opbygge antigene spidsproteiner til vaccinationer. Afhængigt af hvor meget af spidskoden der bruges, hvilke spaltningssekvenser der indgår, og hvilke dele der stabiliseres, kan der laves meget forskellige proteiner. Det er nok rimeligt at sige, at spidser i fuld længde i store tvivlsomme vektorer eller inaktiverede virale partikler stort set er blevet mindre fremhævet til fordel for mindre, men mere immunogene blandinger.
Lunger og blodkar er bestemt kritiske områder af bekymring i enhver SARS-CoV-2-infektion, men hvad vores dyrebare neuroner - kan spike fusionere dem også? Det er klart, at det kan fusionere neuroner i hjernens organoider, men så igen, hvad kan forskere ikke gøre med disse øjeblikkelige forskningspublikationsmirakler. Når man ser mere skarpt på andre typer vira, ser fusionen af neuroner, gliaceller og endda axoner ud til at være på niveau med kurset i at forårsage et utal af potentielle neurologiske problemer. For eksempel slår pseudorabies-viruset bro over synapser for elektrisk at koble neuronernes aktivitet ved at fusionere deres axoner. Fusions med glia er på samme måde blevet opdaget og forbundet med vedvarende neuropatisk smerte efter den akutte fase af herpes zoster (helvedesild). Fra denne onsdag er vi alle yderligere klar over, at SARS-CoV-2 kan bruge proteinet vimentin som en måde at inficere endotelceller på. Det burde ikke undslippe nogens varsel, eller i det mindste neuroforskernes varsel, at vimentin er den primære markør, der bruges til at identificere gliaceller.
Derudover antyder det hurtigt voksende arbejde, der ser på reaktivering af endogen retrovirus i neurodegenerativ sygdom, yderligere for det rationelle sind, at cellefusion også kan være involveret i denne form for patologi.
Sidste artikelHvad overvintrende egern kan lære astronauter
Næste artikelHvordan klimaændringer vil påvirke planter
 Varme artikler
Varme artikler
-
 Et nyt gen i pattedyr, der styrer en ny struktur fundet i nervecellerFylogenetisk træ af PGBD1 og PGBD2. Tilstedeværelsen af de transposase-afledte, SCAN- og KRAB-domænerne er vist. Den humane PGBD1 og PGBD2 med de tættest beslægtede sekvenser (indeholdende transposa
Et nyt gen i pattedyr, der styrer en ny struktur fundet i nervecellerFylogenetisk træ af PGBD1 og PGBD2. Tilstedeværelsen af de transposase-afledte, SCAN- og KRAB-domænerne er vist. Den humane PGBD1 og PGBD2 med de tættest beslægtede sekvenser (indeholdende transposa -
 Mange flere bakterier har elektrisk ledende filamenterMikrobiolog Derek Lovley og kollegaer ved UMass Amherst rapporterer, at de fandt elektrisk ledende pili eller e-pili i flere bakteriearter end blot den oprindelige Geobacter-opdagelse, han gjorde for
Mange flere bakterier har elektrisk ledende filamenterMikrobiolog Derek Lovley og kollegaer ved UMass Amherst rapporterer, at de fandt elektrisk ledende pili eller e-pili i flere bakteriearter end blot den oprindelige Geobacter-opdagelse, han gjorde for -
 Flagermus og insekter kæmper i tropernePanamas katydider kommer i alle størrelser, viser ekstremerne af artsdiversitet. Kredit:Sharon Martinson i de tropiske regnskove i Panama, Dartmouths Hannah ter Hofstede er vidne til, hvad Charles
Flagermus og insekter kæmper i tropernePanamas katydider kommer i alle størrelser, viser ekstremerne af artsdiversitet. Kredit:Sharon Martinson i de tropiske regnskove i Panama, Dartmouths Hannah ter Hofstede er vidne til, hvad Charles -
 Sjældne trofiske æg bag slangehovedfiskenes succes?Slangehoved han vogter sin yngel. Kredit:Valter Weijola Fisk fodrer sjældent deres unger. En undtagelse er visse arter af slangehoveder, hvis afkom lever af trofiske æg leveret af deres forælder. E
Sjældne trofiske æg bag slangehovedfiskenes succes?Slangehoved han vogter sin yngel. Kredit:Valter Weijola Fisk fodrer sjældent deres unger. En undtagelse er visse arter af slangehoveder, hvis afkom lever af trofiske æg leveret af deres forælder. E
- Store grønlandske gletsjer kollaps for 90 år siden forbundet med klimaændringer
- Google-søgninger afslører tværkulturelt ønske om at bestille madlevering på bestemte tidspunkte…
- Blynedfald fra Notre Dame-branden blev sandsynligvis overset
- Hvad er reaktanterne ved fotosyntesen?
- Ingen AI i humor:R2-D2 går ind i en bar, fatter ikke joken
- NASA måler støv på sne for at hjælpe med at styre Colorado -flodbassinets vandforsyninger


