Et nyt gen i pattedyr, der styrer en ny struktur fundet i nerveceller
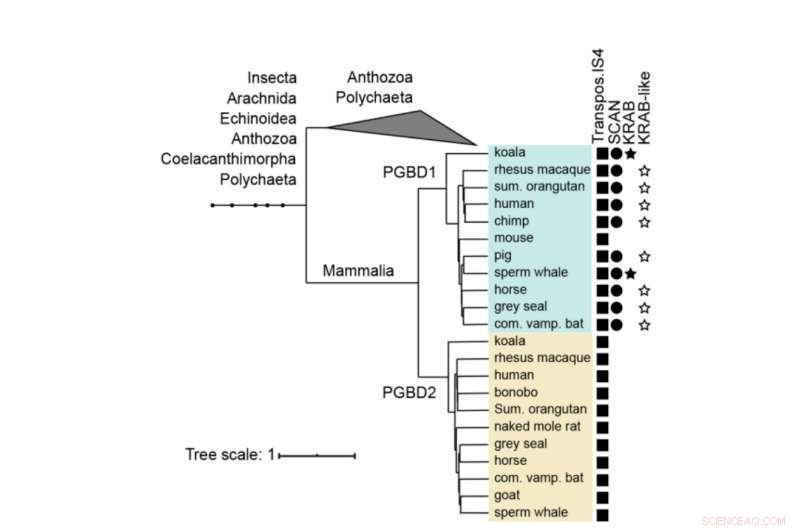
Fylogenetisk træ af PGBD1 og PGBD2. Tilstedeværelsen af de transposase-afledte, SCAN- og KRAB-domænerne er vist. Den humane PGBD1 og PGBD2 med de tættest beslægtede sekvenser (indeholdende transposase IS4) blev justeret med muskler, og et træ blev bygget ved hjælp af MrBayes. Proteindomæner blev annoteret med hmmerscan og CDD (NCBI). KRAB-domænet blev kommenteret med Phyre2. Kredit:Molekylær biologi og evolution (2022). DOI:10.1093/molbev/msac175
Evolution bliver ofte portrætteret som en "tulle"-proces, der gør brug af små ændringer af allerede eksisterende muligheder. Så hvordan udvikler organismer helt nye strukturer?
En ny undersøgelse af Dr. Zsuzsanna Izsvák fra Max Delbrück Center for Molekylær Medicin i Helmholtz Association (Max Delbrück Center) og professor Laurence Hurst fra Milner Center for Evolution ved University of Bath (UK) fandt bevis for, at udviklingen af et nyt gen understøtter udviklingen af en ny struktur fundet i nerveceller. De beskriver dette usædvanlige gen kaldet piggyBac Transposable Element-derived 1, eller PGBD1, i tidsskriftet Molecular Biology and Evolution .
'Jumping-gener' forårsager mutationer
PGBD1 er et af fem relaterede PGBD-gener, der viser en tydelig lighed med piggyBac-elementet, der først blev identificeret i insekter - deraf navnet piggyBac Transposable Element-derived. PiggyBac-elementerne er "hoppende gener", også kaldet transposoner. De er i stand til at kopiere sig selv og flytte fra et sted i genomet til et andet, nogle gange introducerer de mutationer eller ændrer funktioner. PiggyBac-transposoner ankom til vores art ved horisontal overførsel - svarende til hvordan nogle vira kan integrere deres genom i vores DNA.
Men mens piggyBac-transposonerne har mistet deres evne til at hoppe rundt i vores DNA over tid, er fem piggyBac Transposable Element-afledte gener (PGBD1-5) blevet fikseret i mennesker. "Vi havde til formål at finde ud af, hvilken potentielt nyttig funktion PGBD-generne kan have," siger Zsuzsanna Izsvák. "Til denne undersøgelse fokuserede vi på PGBD1."
Blandt de fem PGBD-gener er PGBD1 unik ved, at det også har inkorporeret dele af andre gener, hvilket resulterer i et protein, der har ekstra dele, der er i stand til at binde andre proteiner og binde DNA. PGBD1 er således et nyt gen, der dels er et humant genfragment, dels et inaktivt springgen.
PGBD1 regulerer nerveceller og deres 'proteinfælder'
PGBD1 findes kun hos pattedyr. Det er især aktivt i celler, der bliver til neuroner. Forskerne undersøgte først, hvor PGBD1-protein binder til DNA, idet de observerede, at det limer sig selv i og omkring gener forbundet med nerveudvikling. De fandt ud af, at PGBD1 kontrollerer nervecelleudviklingen ved at blokere gener udtrykt i modne nerveceller, mens de holder de gener, der er forbundet med at være pre-nerveceller aktiverede. Reduktion af niveauet af PGBD1 i præ-nerveceller fik dem til at begynde at udvikle sig som nerveceller.
Et af de gener, som PGBD1-protein binder, tiltrak især deres interesse. NEAT1 er et mærkeligt gen, der koder for et RNA, som usædvanligt ikke så fortsætter med at danne et protein. I stedet udgør dette produkt, et ikke-kodende RNA, rygraden i en fysisk struktur, parapletterne. Disse er bittesmå strukturer i kernerne i nogle af vores celler, der fungerer som fælder for nogle RNA'er og proteiner.
Forskerne fandt ud af, at PGBD1-protein i præ-nerveceller binder til NEAT1-genet og forhindrer det i at virke. Men når PGBD1-niveauer falder, stiger NEAT1-RNA-niveauer, parapletter dannes, og celler bliver modne nerveceller. PGBD1 har således udviklet sig til at være en nøgleregulator for tilstedeværelse eller fravær af parapletter og dermed regulator for nervecelleudvikling.
Evolution er ikke tilfældig manipulation
Det, der dog er mest spændende, er, at parapletter, ligesom PGBD1, også er pattedyrspecifikke. PGBD1 er så et sjældent eksempel på et nyt gen, der har udviklet sig til at regulere en ny struktur, omend en ret lille. Zsuzsanna Izsvák, co-senior forfatter fra Max Delbrück Center, siger:"Dette er en virkelig usædvanlig og serendipital opdagelse. Vi har vidst, at duplikering af allerede eksisterende gener kan understøtte udviklingen af nyheder, men dette er et sjældent eksempel på, at evolution gør mere end bare at pille ved. Dette er et nyt gen til at kontrollere en ny struktur." Det spændende spørgsmål er nu, om det også spiller en rolle i voksne neuroner.
Medseniorforfatter professor Laurence Hurst fra Milner Center for Evolution ved University of Bath tilføjer, at de "har fundet ud af, hvordan paraplettes styres, nu mangler vi bare at finde ud af, hvordan paraplettet selv udviklede sig. Dette kan være en meget sværere opgave da ikke-kodende RNA'er som NEAT1 har tendens til at være hurtigt udviklende og derfor svære at spore over evolutionær tid."
Denne kobling mellem NEAT1 og PGBD1 kan også være involveret i skizofreni. Mens NEAT1 tidligere har været forbundet med denne neurologiske sygdom, identificerede holdet nogle mutationer i PGBD1, som de kunne vise, var også almindelige hos patienter med skizofreni - en af disse mutationer ændrer proteinet i PGBD1, mens andre kan kontrollere dets niveau.
Førsteforfatter Dr. Tamas Raskó, på tidspunktet for undersøgelsen, en postdoktor i gruppen af Zsuzsanna Izsvák, siger, at "det er helt sikkert mere end tilfældigt, at begge gener er involveret i skizofreni. Det er meget usædvanligt at finde en mutation, der ændrer en protein, der er koblet til denne sygdom. Virkningerne af denne mutation skal prioriteres i yderligere undersøgelser." + Udforsk yderligere
Forskere afslører mysteriet om gener, der er nøglen til hjernens udvikling
 Varme artikler
Varme artikler
-
 Mandlige mammutter faldt oftere i naturlige fælder og døde, DNA -bevis tyder påEn mammut stødtand på Wrangel Island. Kredit:Patrícia Pe č nerová Forskere, der har kønnet 98 uldne mammutprøver indsamlet fra forskellige dele af Sibirien, har opdaget, at de forstenede re
Mandlige mammutter faldt oftere i naturlige fælder og døde, DNA -bevis tyder påEn mammut stødtand på Wrangel Island. Kredit:Patrícia Pe č nerová Forskere, der har kønnet 98 uldne mammutprøver indsamlet fra forskellige dele af Sibirien, har opdaget, at de forstenede re -
 Undersøgelse belyser genetisk oprindelse af hudfarve mangfoldighedEn banebrydende undersøgelse undersøger de genetiske grundlag for menneskelig hudfarve, at finde, at genvariationer bag lys hud hos europæere stammer fra Afrika. DeAgostini/Phillip Lee Harvey/Nigel Pa
Undersøgelse belyser genetisk oprindelse af hudfarve mangfoldighedEn banebrydende undersøgelse undersøger de genetiske grundlag for menneskelig hudfarve, at finde, at genvariationer bag lys hud hos europæere stammer fra Afrika. DeAgostini/Phillip Lee Harvey/Nigel Pa -
 Faldende bestande af dronningkonkylier er fragmenterede, og det ændrer bevaringsspilletGratis dykkerfiskeri efter dronningekonkylie. Kredit:Claudio Contreras, International League of Conservation Photographers. Dronningen konkylie, et havbløddyr værdsat for sit spiselige kød og dets
Faldende bestande af dronningkonkylier er fragmenterede, og det ændrer bevaringsspilletGratis dykkerfiskeri efter dronningekonkylie. Kredit:Claudio Contreras, International League of Conservation Photographers. Dronningen konkylie, et havbløddyr værdsat for sit spiselige kød og dets -
 Cellevagten, der neutraliserer hepatitis BKonfokale mikroskopibilleder, der viser i cellekernen (blå), rekrutteringen af Smc5/6 (grøn) af SLF2 (rød) til PML-kroppe. Kredit:© UNIGE – Laboratory of Professor Michel Strubin – Regulering af hep
Cellevagten, der neutraliserer hepatitis BKonfokale mikroskopibilleder, der viser i cellekernen (blå), rekrutteringen af Smc5/6 (grøn) af SLF2 (rød) til PML-kroppe. Kredit:© UNIGE – Laboratory of Professor Michel Strubin – Regulering af hep
- Kosmologiske gravitationsbølger:En ny tilgang til at nå tilbage til Big Bang
- Beskrivelse af de fire typer af akvatiske økosystemer
- Fiat Chrysler, Peugeot skal skabe fjerde største bilproducent
- Hule porfyrine nanosfærer
- Cassini begynder de sidste fem kredsløb omkring Saturn
- Arbejder mod grøn vækst i by-Kina


